Det har vært drømmen til kvinner – og menn – i århundrer. Nå sier forskere at de har funnet en måte å reversere aldringsprosessen i menneskelig hud.
Forskere i Cambridge avslører at de har omprogrammert hudceller fra personer i alderen 38 og 53 for å gjøre dem 30 år "yngre".
Prosedyren skrur den aldrende klokken lenger tilbake enn tidligere omprogrammeringsprosedyrer uten å skade cellene.
Forskere sier at de til og med delvis kan gjenopprette funksjoner som gikk tapt i eldre celler.
Mens forskningen fortsatt er i de tidlige stadiene, kan funnene til slutt revolusjonere regenerativ medisin, spesielt hvis de kan replikeres i andre celletyper og annet vev i kroppen, hevder forskerne.
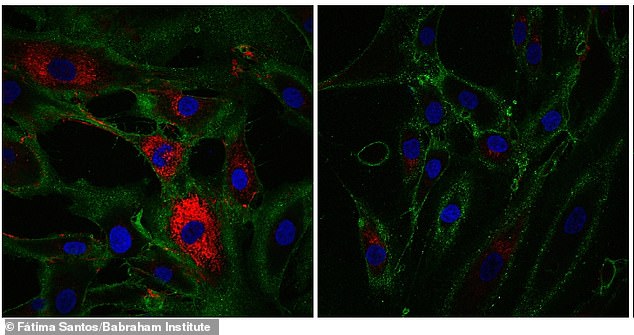
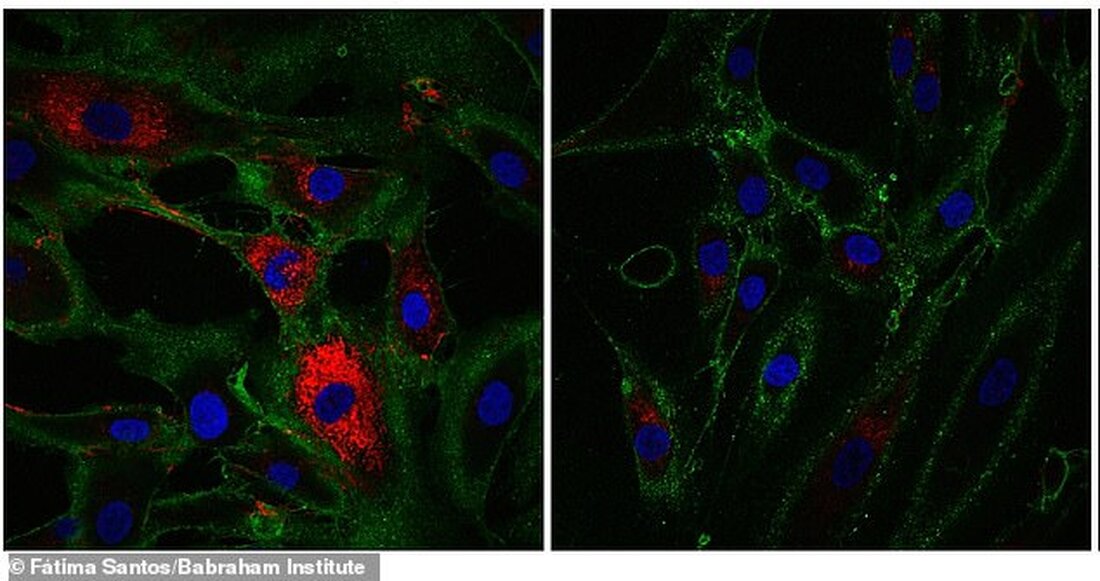
I eksperimenter hadde aldrende celler gjenvunnet markører som er karakteristiske for hudceller som produserer kollagen, et molekyl som finnes i bein, hudsener og leddbånd som hjelper til med å strukturere vev og helbrede sår. Her viser rødt kollagenproduksjon av hudceller kalt fibroblaster
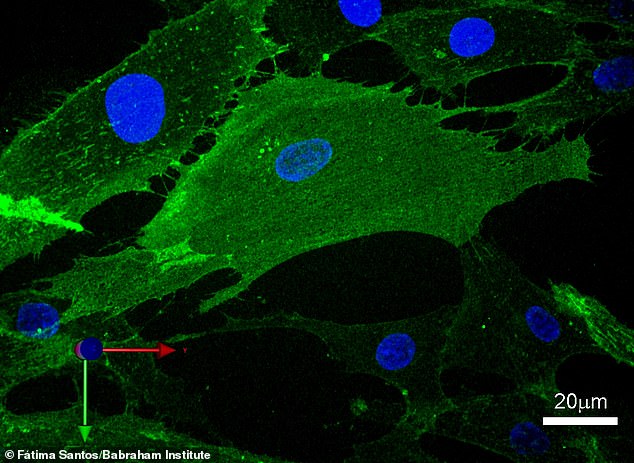
Celler endrer midlertidig form under midlertidig omprogrammering. Dette bildet viser en enkelt celle med fibroblastoverflatemarkører i grønt
Aldrende celler i eksperimenterble mer som hudceller kalt fibroblaster, som produserer kollagen, et protein som holder kroppen sammen og holder den sterk.
Antall fibroblaster i menneskelig hud avtar gradvis med alderen. Disse cellene krymper også når vi blir eldre.
De nye funnene kan føre til en målrettet tilnærming til behandling av aldring som kan "revolusjonere" regenerativ medisin, sier forskere.
Den nye forskningen ble utført ved Babraham Institute, et biovitenskapelig forskningsinstitutt i Cambridge, og publisert i tidsskriftet eLife.
"Våre resultater representerer et stort fremskritt i vår forståelse av celleomprogrammering," sa Dr. Diljeet Gill fra Babraham Institute.
"Vi har bevist at celler kan forynges uten å miste funksjonen, og at foryngelse tar sikte på å gjenopprette en viss funksjon til gamle celler.
"Det faktum at vi også så en reversering av aldringsindikatorer i sykdomsassosierte gener er spesielt lovende for fremtiden til dette arbeidet."
Med økende alder reduseres funksjonaliteten til cellene og genomet – deres DNA-plan – blir beriket med tegn på aldring.
Regenerativ biologi har som mål å reparere eller erstatte celler, selv gamle.
Et av de viktigste verktøyene innen regenerativ biologi er vår evne til å lage "induserte" stamceller.
Imidlertid sletter denne prosessen i hovedsak cellene for deres funksjon, og gir dem potensialet til å bli en hvilken som helst celletype.
Arbeidet stammer opprinnelig fra arbeidet ved Roslin Institute i Edinburgh på 1990-tallet med å gjøre en brystcelle tatt fra en seks år gammel sau til et embryo.
Dette prosjektet førte som kjent til opprettelsen av sauen Dolly, det første pattedyret klonet fra en voksen somatisk celle.
Dollys skapelse viste at gener i kjernen til en moden celle fortsatt er i stand til å gå tilbake til en embryonal totipotent tilstand - noe som betyr at cellen kan dele seg for å produsere alle et dyrs forskjellige celler.

Sauen Dolly (bildet) ble født i juli 1996 ved Roslin Institute i Edinburgh. Den ble dyrket fra en brystcelle fra en seks år gammel sau
Dette banet vei for Nobelprisvinnende vitenskapsmann Dr. Shinya Yamanaka, som i 2007 ble den første forskeren som konverterte normale celler som har en spesifikk funksjon til stamceller som har den spesielle evnen til å utvikle seg til en hvilken som helst celletype.
Denne metoden, kalt IPS, tar omtrent 50 dager og bruker fire nøkkelmolekyler kalt Yamanaka-transkripsjonsfaktorer – Oct4, Sox2, Klf4 og cMyc.
Babraham Institutes nye metode, kalt Maturation Phase Transient Reprogramming, utsetter celler for Yamanaka-faktorer i bare 13 dager i stedet for 50.
På dette tidspunktet hadde cellene ennå ikke blitt til embryonale stamceller, men ble "forynget" som om de var 30 år yngre.
De delvis omprogrammerte cellene fikk tid til å vokse under normale forhold for å observere om deres spesifikke hudcellefunksjon kom tilbake.
Den genomiske analysen viste at cellene hadde gjenvunnet markører som er karakteristiske for hudceller (fibroblaster), noe som ble bekreftet ved å observere kollagenproduksjonen i de omprogrammerte cellene.
For å vise at cellene hadde forynget seg, lette forskerne etter endringer i egenskapene til aldring.

Forskningen inkluderer såkalte Yamanaka-transkripsjonsfaktorer, oppkalt etter den nobelprisvinnende japanske vitenskapsmannen Dr. Shinya Yamanaka (bildet).
Forskerne undersøkte flere mål på cellealder. Den første er den epigenetiske klokken, der kjemiske merker som er tilstede i hele genomet indikerer alder.
Den andre er transkriptomet, alle genavlesningene produsert av cellen.
Gjennom disse to tiltakene matchet de omprogrammerte cellene profilen til celler som var 30 år yngre sammenlignet med referansedatasett, sa teamet.
Teknikken kan ikke umiddelbart oversettes til en klinisk setting fordi PD øker risikoen for kreft.
Foreløpig er de neste forskningstrinnene å forstå den eksakte mekanismen som gjorde denne delvise omprogrammeringen mulig, men til slutt kan den brukes til celleterapi i situasjoner der cellenes alder utgjør en forskjell, for eksempel: B. i hudhelbredelse fra brannskader.
Potensielle anvendelser av denne teknikken avhenger av at cellene ikke bare virker yngre, men også fungerer som unge celler.
Fibroblaster produserer kollagen, et molekyl som finnes i bein, hudsener og leddbånd som bidrar til å strukturere vev og helbrede sår.
De foryngede fibroblastene produserte flere kollagenproteiner sammenlignet med kontrollceller som ikke hadde gjennomgått omprogrammeringsprosessen, fant Babraham Institute-forskere.
Fibroblaster beveger seg også inn i områder som trenger reparasjon, så forskerne testet de delvis foryngede cellene ved å lage et kunstig kutt i et lag med celler i en tallerken.
De fant ut at de behandlede fibroblastene deres beveget seg inn i gapet raskere enn eldre celler - et lovende tegn på at det en dag kunne lages celler som er bedre til å helbrede sår.
Forskerne ønsker også å se om den nye metoden virker på annet vev som muskel, lever og blodceller.
I fremtiden vil denne forskningen også kunne åpne for andre terapeutiske muligheter; Forskerne observerte at metoden deres også hadde effekter på andre gener knyttet til aldersrelaterte sykdommer og symptomer.
APBA2-genet, som er assosiert med Alzheimers sykdom, og MAF-genet, som spiller en rolle i utviklingen av grå stær, viste begge endringer i retning av ungdommelige transkripsjonsnivåer.

De nye funnene kan føre til en målrettet tilnærming til behandling av aldring som kan "revolusjonere" regenerativ medisin (filbilde)
Mekanismen bak vellykket midlertidig omprogrammering er ennå ikke fullt ut forstått og er den neste brikken i puslespillet som skal utforskes.
Forskerne spekulerer i at nøkkelregioner av genomet som er involvert i dannelsen av celleidentitet kan unnslippe omprogrammeringsprosessen.
Professor Wolf Reik, en gruppeleder i epigenetikkforskningsprogrammet som nylig flyttet til å lede Altos Labs Cambridge Institute, sa: "Dette arbeidet har veldig spennende implikasjoner.
"Vi kan være i stand til å identifisere gener som forynges uten omprogrammering og målrette dem for å redusere effekten av aldring.
"Denne tilnærmingen lover verdifulle oppdagelser som kan åpne for fantastiske terapeutiske horisonter."
Professor Reik forteller BBC at begrepene ungdomseliksir eller antialdringspille ikke er helt absurd.
"Teknikken har blitt brukt på genmodifiserte mus, og det er noen tegn på foryngelse," sa han.
"En studie viste tegn på en forynget bukspyttkjertel, som er interessant for potensialet til å bekjempe diabetes."

 Suche
Suche
 Mein Konto
Mein Konto