Unheilbar: Kinderhirntumor mit vielversprechender Immuntherapie
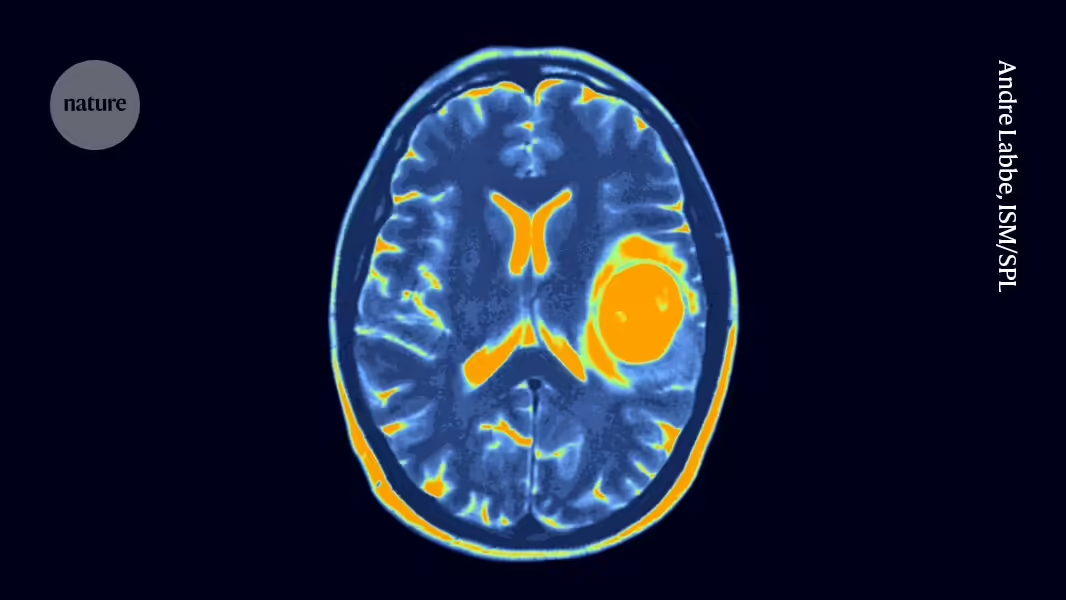
Jeden zweiten Wochenbesuch in Seattle Children’s Hospital in Washington kommt ein fünfjähriges Kind für eine frische Dosis genetisch veränderter Immunzellen vorbei, die direkt in die Flüssigkeit um ihr Gehirn herum verabreicht werden.
Das Kind macht diese Besuche schon seit mehr als drei Jahren, nachdem bei ihm eine verheerende Form von Hirn- und Rückenmarkskrebs namens diffuses Mittelliniengliom diagnostiziert wurde, für die es keine bekannte Heilung gibt. Aber die Behandlung, die CAR-T-Zelltherapie genannt wird, scheint den Tumor verkleinert und unter Kontrolle gehalten zu haben. Bei 70 Behandlungen und zählend hat dieses fünfjährige Kind möglicherweise mehr Dosen der CAR-T-Zelltherapie erhalten als irgendjemand sonst auf dem Planeten.
Sein Onkologe Nicholas Vitanza strahlt immer, wenn er über die Ergebnisse spricht. Dennoch ist sich Vitanza sehr wohl bewusst, dass die Reaktion des Kindes ungewöhnlich ist. Obwohl mehrere Kinder in Vitzanas klinischer Studie möglicherweise auch von der CAR-T-Zelltherapie profitiert haben, waren die meisten Reaktionen nicht so dramatisch oder lang anhaltend wie die des fünfjährigen Kindes. Die Frage, die Vitanza und andere in seinem Feld nachts wach hält, lautet nun: Wie können sie diesen Erfolg weniger zu einem Ausreißer machen?
Auf dem Internationalen Symposium für Pädiatrische Neuro-Onkologie in Philadelphia, Pennsylvania, das Anfang dieses Monats endete, präsentierten Vitanza und andere Forscher vielversprechende frühe klinische Studienergebnisse, die darauf hindeuteten, dass CAR-T-Zellen eine wirksame Behandlung für tödliche ZNS-Krebsarten bei Kindern sein könnten.
Die Studien waren darauf ausgelegt, die Sicherheit der Therapie zu testen, nicht ihre Wirksamkeit, und größere Studien sind erforderlich, um sicher zu wissen, ob die Behandlungen von Nutzen sind. In der Zwischenzeit sind die Forscher bestrebt, ihre Herangehensweise zu optimieren, um ihre Reichweite zu maximieren. „Wir sehen einen Einblick in ein Signal“, sagt Jasia Mahdi, eine Pädiatrische Neurologin am Texas Children’s Hospital in Houston. „Unsere Aufgabe besteht jetzt darin, herauszufinden, wie wir darauf aufbauen können.“
Tumor-finde T-Zellen
CAR-T-Zelltherapien bestehen aus Immunzellen namens T-Zellen, die vom Empfänger entfernt und so verändert wurden, dass sie Moleküle namens chimäre Antigenrezeptoren (CAR) auf ihrer Oberfläche produzieren. Diese T-Zellen werden dem Körper wieder zugeführt, wo ihre neuen Rezeptoren es ihnen ermöglichen, Krebszellen zu erkennen und zu zerstören.
Trotz anhaltender Sicherheitsbedenken hat sich der Ansatz als erfolgreich bei der Behandlung mehrerer Blutkrebsarten erwiesen und in einigen Fällen langanhaltende Remissionen von mehr als einem Jahrzehnt hervorgerufen. Die Anwendung von CAR-T-Zelltherapien zur Behandlung von soliden Tumoren wie denen des Gehirns und der Lunge ist jedoch anspruchsvoller. Solide Tumoren können verschiedene Zellen mit unterschiedlichen Mutationen und unterschiedlichen Empfindlichkeiten gegenüber der Therapie enthalten. Solide Tumoren können auch für die T-Zellen schwieriger zu durchdringen sein.
Dennoch haben Studien an Mäusen darauf hingedeutet, dass CAR T-Zellen gegen diffuse Mittelliniengliome wirksam sein könnten. Neue Therapien für den Krebs werden dringend benötigt: Die Standardbehandlung besteht gelegentlich aus Strahlentherapie in Kombination mit Chemotherapie, aber der Krebs ist tödlich und die mittlere Überlebensdauer beträgt etwa 13 Monate nach der Diagnose, sagt Vitanza.
Erfolg: ein Diplom
Nun sind die ersten klinischen Studien zur CAR-T-Therapie gegen diffuse Mittelliniengliome bei Kindern abgeschlossen und die Ergebnisse sind vielversprechend. Bei dem Treffen in Philadelphia präsentierte Vitanza Daten aus einer Studie, in der 21 Kinder mit diffuser Mittelliniengliomen mit CAR-T-Zellen behandelt wurden, die ein Protein namens B7-H3 angreifen, das hauptsächlich auf Krebszellen zu finden ist. Nur ein Teilnehmer hatte eine starke Reaktion auf die Behandlung selbst, und einige leben länger als erwartet, sagt Vitanza.
Mahdi präsentierte Daten aus einer klinischen Studie zu einer T-Zelltherapie, die eine Molekül namens GD2 angreift. In dieser Studie, die an der Stanford University in Kalifornien durchgeführt wurde, wurden neun Menschen mit diffusen Mittelliniengliomen behandelt, und die Tumore schrumpften bei vier von ihnen um mehr als die Hälfte.
Auch diese Studie hatte einen Ausreißer: Ein junger Mann, dessen Krebs vollständig verschwunden ist und der seit mehr als 30 Monaten nach seiner ersten Behandlung krebsfrei geblieben ist. In dieser Zeit hat er die Highschool abgeschlossen und gedeiht nun an der Universität. „All diese normalen Dinge bedeuten in diesem Kontext so viel mehr“, sagt Mahdi. „Diese Realität wäre sonst nicht seine gewesen.“
Ein Menü an Optionen
Die Forscher sind bestrebt, diese dramatischen Reaktionen auf mehr ihrer Studienteilnehmer auszudehnen. Vitzanas Team hat eine weitere Studie gestartet, in der CAR-T-Zellen getestet werden, die vier verschiedene Moleküle angreifen, die hauptsächlich auf Gehirn- und Rückenmarkstumoren zu finden sind, in der Hoffnung, dass T-Zellen, die mehrere Ziele erkennen, wirksamer sein werden.
Ein weiteres Team an der University of California, San Francisco, testet CAR-T-Zellen, die den krebstötenden Rezeptor nur dann exprimieren, wenn sich die Zellen im Zentralnervensystem befinden. Die Hoffnung besteht darin, dass die T-Zellen nur dort aktiv sind, wo sie benötigt werden, was sie weniger anfällig dafür macht, durch „Erschöpfung“ funktionsgestört zu werden, ein Phänomen, das bekannt ist, die Wirksamkeit von T-Zelltherapien zu begrenzen, sagt Hideho Okada, der Immuntherapien erforscht und leitender Ermittler des Projekts ist. Das Team behandelte seinen ersten Studienteilnehmer, einen Erwachsenen mit einem aggressiven Gehirntumor namens Glioblastom, im Juni und plant, eine ähnliche Studie bei Kindern zu starten.
Derartige Modifikationen von CAR-T-Zelltherapien sind erst der Anfang, sagt Vitanza. Forscher suchen nach weiteren Möglichkeiten, um CAR-T-Zelltherapien zu optimieren, und in Jahrzehnten könnten Ärzte aus einer Vielzahl von Optionen wählen können, die individuell auf Patienten zugeschnitten werden können. „Es ist unglaublich, dass wir an diesen Punkt gekommen sind“, sagt er. „Aber in 20 Jahren werden die CAR-T-Zellen, die wir für Patienten verwenden, sehr verschieden aussehen.“

