Tutkijat kehittävät ihmisen sylkirauhasten organoideja testatakseen SARS-CoV-2:n tarttuvuutta
Äskettäin Nature Cell Biology -lehdessä julkaistussa tutkimuksessa tutkijat osoittivat sylkirauhasten herkkyyden vakavalle akuutin hengitystieoireyhtymän koronavirus-2:n (SARS-CoV-2) infektiolle in vitro käyttäen organoidiviljelymallia. Tutkimus: Ihmisen aiheuttama pluripotentti kantasoluperäinen sylkirauhasen organoidi malli SARS-CoV-2-infektiota ja replikaatiota. Kuvan luotto: NIAID Tausta Vaikka hengityselimet, mukaan lukien ylähengitystiet (URT) ja keuhkot, ovat SARS-CoV-2:n ensisijaisia kohteita, on yhä enemmän todisteita siitä, että se vaikuttaa useisiin elimiin. Esimerkiksi suun limakalvo ja sylkirauhaset ilmentävät laajalti kahta SARS-CoV-2:n sisäänpääsytekijää, angiotensiinia konvertoivaa entsyymiä 2 (ACE2) ja transmembraanista seriiniproteaasi 2:ta (TMPRSS2). Ne toimivat myös säiliönä SARS-CoV-2:lle. …
Tutkijat kehittävät ihmisen sylkirauhasten organoideja testatakseen SARS-CoV-2:n tarttuvuutta
Äskettäin lehdessä julkaistussa tutkimuksessa Luonnollinen solubiologia Tutkijat osoittivat in vitro sylkirauhasten herkkyyden vakavalle akuutin hengitystieoireyhtymän koronavirus-2 (SARS-CoV-2) -infektiolle organoidiviljelymallilla.
tausta
Vaikka hengityselimet, mukaan lukien ylähengitystiet (URT) ja keuhkot, ovat SARS-CoV-2:n tärkeimmät kohteet, on yhä enemmän todisteita siitä, että se vaikuttaa useisiin elimiin. Esimerkiksi suun limakalvo ja sylkirauhaset ilmentävät laajalti kahta SARS-CoV-2:n sisäänpääsytekijää, angiotensiinia konvertoivaa entsyymiä 2 (ACE2) ja transmembraanista seriiniproteaasi 2:ta (TMPRSS2). Ne toimivat myös säiliönä SARS-CoV-2:lle.
Mielenkiintoista on, että 80 % SARS-CoV-2-tartunnoista on oireettomia. Lisäksi tutkimukset ovat raportoineet, että SARS-CoV-2 kohdistuu ihmisen sylkirauhasiin ja oireettomien yksilöiden syljestä peräisin olevat tarttuvat virionit edistävät viruksen leviämistä.
Koska SARS-CoV-2 kykenee infektoimaan monenlaisia organoideja, organoidiviljelymalli voi osoittautua sopivaksi havaita SARS-CoV-2-infektio sylkirauhasissa (in vitro). Sopivien in vitro -mallien puuttumisen vuoksi tutkimukset eivät kuitenkaan ole onnistuneet selvittämään SARS-CoV-2:n infektion ja replikaation taustalla olevia mekanismeja sylkirauhasissa ja myöhempään sylkeen erittymiseen.
Tietoja tutkimuksesta
Tässä tutkimuksessa tutkijat loivat toiminnallisia sylkirauhasen organoideja ihmisen indusoimista pluripotenteista kantasoluista (hiPSC:t), joilla on samanlaiset morfologiset ominaisuudet ja fysiologiset toiminnot (in vivo) kuin ihmisen sylkirauhasilla. Lisäksi näillä organoideilla oli sylkirauhasspesifisiä solulinjoja.
Ryhmä suoritti hiSG-solujen yksisoluisen ribonukleiinihapposekvensoinnin (scRNA-seq) päivänä 80 käyttämällä 10X Genomics -alustaa. Lisäksi he eristivät organoidit päivänä 60 ja viljelivät niitä fibroblastikasvutekijän (FGF) 7 ja 10 kanssa päivään 80 saakka havaittujen haarautumisrakenteiden karakterisoimiseksi.
SRY-box-transkriptiotekijä 9 (SOX9) -geeni säätelee sylkirauhasten kehitystä hiirillä ja ihmisillä. Sen puuttuessa sylkirauhaset eivät voi käydä läpi haarautumismorfogeneesiä. Siksi tutkijat tukahduttivat SOX9:n hiSG-induktion aikana selvittääkseen, kiteyttivätkö hiSG:t SOX9-välitteisen kehitysprosessin.
Tutkimustulokset
Ihmisen aiheuttamilla sylkirauhasilla (hiSG:t) oli samanlaisia ominaisuuksia kuin alkion sylkirauhasissa, mukaan lukien morfologiset ominaisuudet, proteiinimarkkerin ilmentyminen ja geenin ilmentymisen ominaisuudet. Hiirillä tehtyjen in vivo -tutkimusten mukaisesti SOX9-knockdown esti haaran muodostumista hiPSC:issä, mikä viittaa siihen, että tämä geeni on kriittinen ihmisen sylkirauhasten kehitykselle. Siten tämä tutkimusmalli voisi korvata ihmisen sylkirauhasten kehityksen tutkimiseen käytetyt eläinmallit.
hiSG:t matkivat morfologisesti ja toiminnallisesti luonnollisia sylkirauhasia. Puolueeton scRNA-seq-klusterointi tunnisti kuusi pääsoluryhmää, jotka jakautuvat edelleen solualatyyppeihin. HiSG:iden pieni mesenkymaalipopulaatio ei osoittanut sylkirauhasten mesenkyymin piirteitä. Sitä vastoin epiteelisoluryhmä koostui viidestä soluryhmästä: akinaarisista, tyvisoluista, duktaalisista, myoepiteelisoluista ja aktiivisesti kiertävistä soluista. HiSG:t käsittivät riippumattomia perusmyoepiteelisolujen linjoja duktaali-asinaarisesta linjasta, ja pseudoaika-analyysi osoitti erot näiden kahden solulinjan välillä.
Sylkirauhasten perustehtävä on erittää asetyylikoliinin aiheuttamaa nestettä muskariinin asetyylikoliinireseptorien kautta. HiSG:ssä hoito karbakolilla, muskariiniasetyylikoliinireseptorin agonistilla, johti ohimenevään ja annoksesta riippuvaiseen solunsisäisten kalsiumtasojen nousuun. Lisäksi ortotooppisesti siirretyt hiSG:t osoittivat kypsien sylkirauhasten fenotyyppiä, jotka oli siirretty vastaanottajakohtaan hiirillä ajan myötä.
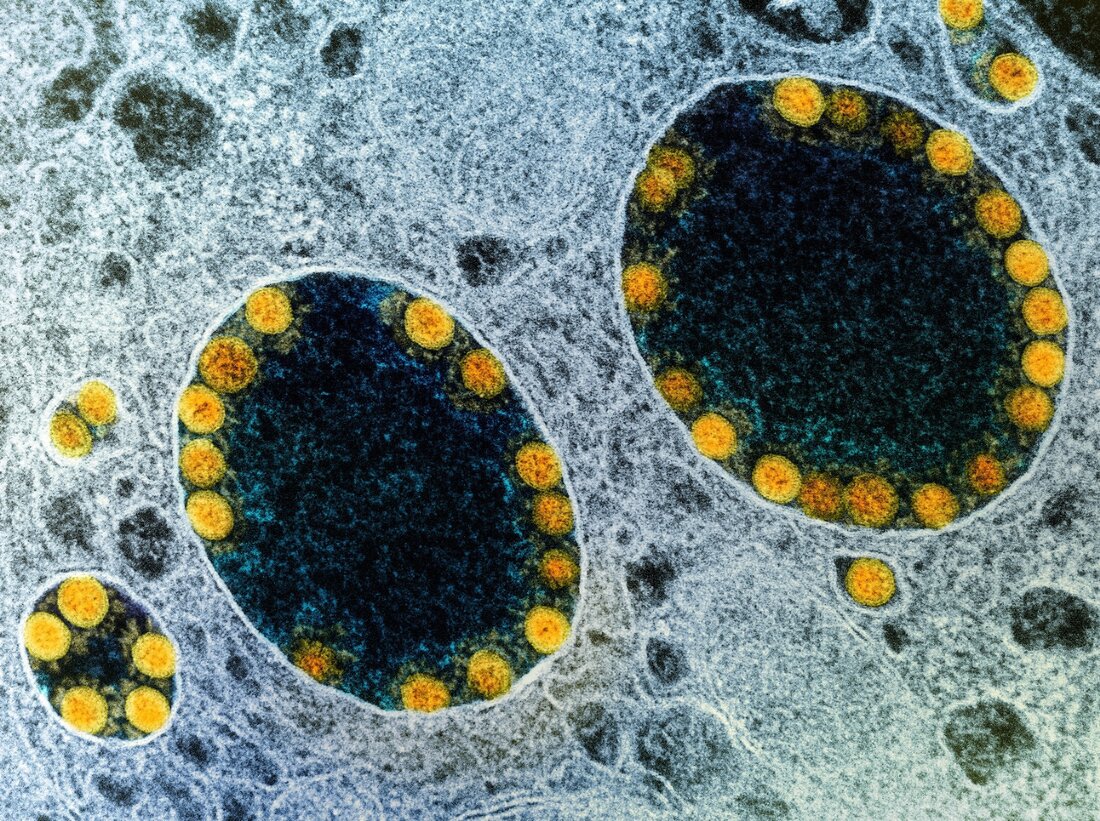
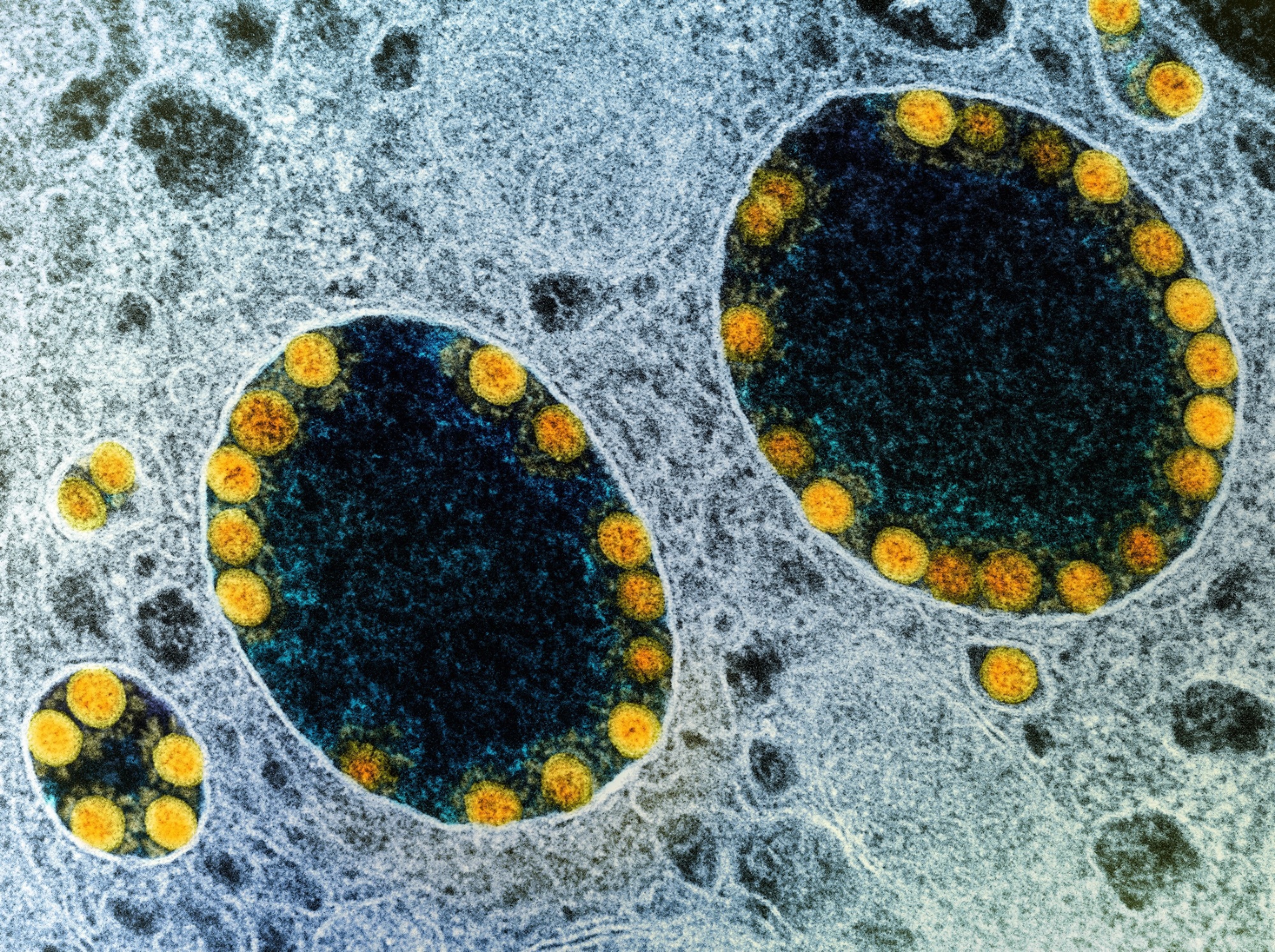
scRNA-seq- ja immunofluoresenssianalyysit osoittivat myös, että hiSG-solut ilmensivät runsaasti ACE2:ta ja TMPRSS2:ta, samalla tavalla kuin normaalit sylkirauhaset. Immunovärjäysmenetelmä paljasti, että vaikka hiSG:iden apikaalisen puolen duktaaliset solut ilmensivät voimakkaasti ACE2:ta, duktaalisolut ja akinaarisolut ilmensivät TMPRSS2:ta. Saaduttuaan kosketuksiin SARS-CoV-2:n kanssa hiSG:t infektoituivat ja osoittivat SARS-CoV-2:n replikaatiota 24 tunnin sisällä tartunnasta. Kirjoittajat löysivät myös SARS-CoV-2-nukleoproteiinin infektoituneista kanavasoluista. Vastaavasti väliaineen tarttuvan kudosviljelyn määritys (TCID50) osoitti tarttuvia viruksia hiSG:issä, jotka saavuttivat huippunsa 24 tunnin kohdalla, mutta vähenivät myöhemmin.
Johtopäätökset
Itse asiassa nykyisessä tutkimuksessa kehitetyt hiSG:t voisivat toimia arvokkaana mallina heterogeenisten solupopulaatioiden lisääntymiselle ihmisen sylkirauhasissa. Lisäksi hiSG:t voisivat tukea geenien toiminnallista analyysiä kehityksen aikana ja toimia lupaavana työkaluna SARS-CoV-2-infektioiden tutkimiseen sylkirauhasissa molekyylitasolla. Lisäksi tutkijat osoittivat, että hiSG:illä oli useita etuja verrattuna organoideihin, jotka olivat peräisin aikuisen ihmisen sylkirauhasten kudoskantasoluista. Niitä voitiin esimerkiksi helposti muunnella geneettisesti käyttämällä geeninmuokkaustyökalua CRISPR (klusteroitu säännöllisesti väliin sijoitettu lyhyt palindromitoisto) ja CRISPR-assosioitunut proteiini 9 (Cas9), ja niitä oli suhteellisen helppo viljellä.
Viite:
- Tanaka, J., Senpuku, H., Ogawa, M. et al. Vom Menschen induzierte pluripotente, aus Stammzellen gewonnene Speicheldrüsenorganoide modellieren die SARS-CoV-2-Infektion und -Replikation. Nat Cell Biol (2022). https://doi.org/10.1038/s41556-022-01007-6, https://www.nature.com/articles/s41556-022-01007-6#Sec7

 Suche
Suche
 Mein Konto
Mein Konto
