Wetenschappers ontwikkelen menselijke speekselklierorganoïden om de infectiviteit van SARS-CoV-2 te testen
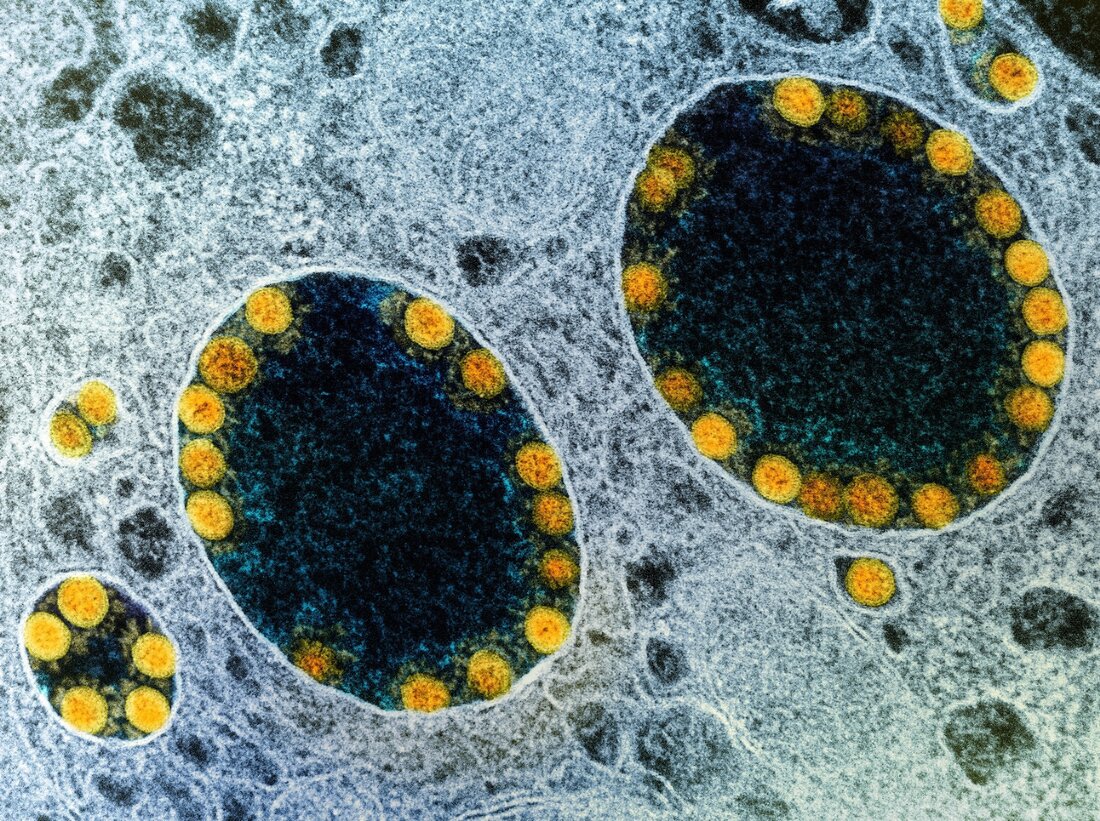
In een recente studie gepubliceerd in het tijdschrift Nature Cell Biology hebben onderzoekers in vitro de gevoeligheid van speekselklieren voor ernstige infectie met het acute respiratoire syndroom coronavirus-2 (SARS-CoV-2) aangetoond met behulp van een organoïde kweekmodel. Studie: Door mensen geïnduceerde pluripotente stamcel-afgeleide speekselklierorganoïden modelleren SARS-CoV-2-infectie en -replicatie. Beeldcredits: NIAID Achtergrond Hoewel het ademhalingssysteem, inclusief de bovenste luchtwegen (URT) en de longen, het belangrijkste doelwit zijn van SARS-CoV-2, zijn er steeds meer aanwijzingen dat het meerdere organen aantast. In het mondslijmvlies en de speekselklieren komen bijvoorbeeld twee SARS-CoV-2-toegangsfactoren tot expressie: angiotensine-converting enzyme 2 (ACE2) en transmembraan-serineprotease 2 (TMPRSS2). Ze dienen ook als reservoir voor SARS-CoV-2. …
Wetenschappers ontwikkelen menselijke speekselklierorganoïden om de infectiviteit van SARS-CoV-2 te testen
Dat blijkt uit een onderzoek dat onlangs in het tijdschrift is gepubliceerd Natuurlijke celbiologie Onderzoekers hebben in vitro de gevoeligheid van speekselklieren voor ernstige infectie met het acute respiratoire syndroom coronavirus-2 (SARS-CoV-2) aangetoond met behulp van een organoïde kweekmodel.
achtergrond
Hoewel het ademhalingssysteem, inclusief de bovenste luchtwegen (URT) en de longen, het belangrijkste doelwit zijn van SARS-CoV-2, zijn er steeds meer aanwijzingen dat het meerdere organen aantast. In het mondslijmvlies en de speekselklieren komen bijvoorbeeld twee SARS-CoV-2-toegangsfactoren tot expressie: angiotensine-converting enzyme 2 (ACE2) en transmembraan-serineprotease 2 (TMPRSS2). Ze dienen ook als reservoir voor SARS-CoV-2.
Interessant genoeg is 80% van de SARS-CoV-2-infecties asymptomatisch. Bovendien hebben onderzoeken gemeld dat SARS-CoV-2 zich richt op menselijke speekselklieren en dat infectieuze virionen uit het speeksel van asymptomatische individuen bijdragen aan verdere virusoverdracht.
Vanwege het vermogen van SARS-CoV-2 om meerdere soorten organoïden te infecteren, kan een organoïdenkweekmodel geschikt blijken om infectie door SARS-CoV-2 in speekselklieren (in vitro) te detecteren. Door het gebrek aan geschikte in vitro modellen zijn onderzoeken er echter niet in geslaagd de mechanismen op te helderen die ten grondslag liggen aan de infectie en replicatie van SARS-CoV-2 in de speekselklieren en de daaropvolgende uitscheiding in het speeksel.
Over de studie
In de huidige studie genereerden onderzoekers functionele speekselklierorganoïden uit door mensen geïnduceerde pluripotente stamcellen (hiPSC's) met vergelijkbare morfologische kenmerken en fysiologische functies (in vivo) als menselijke speekselklieren. Bovendien hadden deze organoïden speekselklierspecifieke cellijnen.
Het team voerde op dag 80 single-cell ribonucleïnezuursequencing (scRNA-seq) van hiSG-cellen uit met behulp van het 10X Genomics-platform. Bovendien isoleerden ze de organoïden op dag 60 en kweekten ze tot dag 80 met fibroblastgroeifactor (FGF) 7 en 10 om de waargenomen vertakkingsstructuren te karakteriseren.
Het SRY-box-transcriptiefactor 9 (SOX9)-gen reguleert de ontwikkeling van de speekselklieren bij muizen en mensen. Bij afwezigheid kunnen de speekselklieren geen vertakkende morfogenese ondergaan. Daarom onderdrukten de onderzoekers SOX9 tijdens hiSG-inductie om erachter te komen of hiSGs het door SOX9 gemedieerde ontwikkelingsproces recapituleerden.
Studieresultaten
De door de mens geïnduceerde speekselklieren (hiSG's) hadden vergelijkbare eigenschappen als embryonale speekselklieren, waaronder morfologische kenmerken, eiwitmarkerexpressie en genexpressiekenmerken. In overeenstemming met in vivo onderzoeken uitgevoerd bij muizen, remde SOX9-knockdown de vorming van vertakkingen in hiPSC's, wat suggereert dat dit gen van cruciaal belang is voor de ontwikkeling van de menselijke speekselklier. Dit studiemodel zou dus diermodellen kunnen vervangen die worden gebruikt om de ontwikkeling van de menselijke speekselklieren te bestuderen.
De hiSG's bootsten morfologisch en functioneel de natuurlijke speekselklieren na. Onpartijdige scRNA-seq-clustering identificeerde zes belangrijke celgroepen die verder deelbaar zijn in cellulaire subtypen. De kleine mesenchymale populatie in de HiSGs vertoonde geen kenmerken van het speekselkliermesenchym. Daarentegen bestond de epitheelcelgroep uit vijf celgroepen: acinaire, basale, ductale, myoepitheliale en actief cyclische cellen. De hiSG's omvatten onafhankelijke afstammingslijnen van basale myoepitheliale cellen uit de ductale-acinaire afstammingslijn, en pseudo-tijdanalyse toonde de verschillen tussen deze twee celafstammingslijnen aan.
De basisfunctie van de speekselklieren is het uitscheiden van door acetylcholine geïnduceerde vloeistof via muscarine-acetylcholinereceptorroutes. Bij hiSGs resulteerde behandeling met carbachol, een muscarine-acetylcholinereceptoragonist, in een voorbijgaande en dosisafhankelijke toename van de intracellulaire calciumspiegels. Bovendien vertoonden orthotopisch getransplanteerde hiSG's het fenotype van volwassen speekselklieren die in de loop van de tijd naar een ontvangende plaats bij muizen waren getransplanteerd.
De scRNA-seq- en immunofluorescentieanalyses toonden ook aan dat de ductale cellen in de hiSG's ACE2 en TMPRSS2 overvloedig tot expressie brachten, vergelijkbaar met normale speekselklieren. De immunokleuringsmethode onthulde dat hoewel ductale cellen aan de apicale kant van hiSGs ACE2 sterk tot expressie brachten, ductale cellen en acinaire cellen TMPRSS2 tot expressie brachten. Bij contact met SARS-CoV-2 raakten hiSG’s geïnfecteerd en vertoonden ze binnen 24 uur na infectie SARS-CoV-2-replicatie. De auteurs ontdekten ook het SARS-CoV-2-nucleoproteïne in geïnfecteerde ductale cellen. Dienovereenkomstig toonde de medium infectieuze weefselkweektest (TCID50) infectieuze virussen in hiSG's aan die na 24 uur een piek bereikten, maar later afnamen.
Conclusies
In feite zouden de hiSG's die in de huidige studie zijn ontwikkeld, kunnen dienen als een waardevol model voor de reproductie van heterogene celpopulaties in menselijke speekselklieren. Bovendien zouden hiSGs de functionele analyse van genen tijdens de ontwikkeling kunnen ondersteunen en kunnen dienen als een veelbelovend hulpmiddel om SARS-CoV-2-infecties in speekselklieren op moleculair niveau te bestuderen. Bovendien toonden de onderzoekers aan dat hiSG's verschillende voordelen hadden vergeleken met organoïden afgeleid van weefselstamvoorlopercellen uit volwassen menselijke speekselklieren. Ze konden bijvoorbeeld gemakkelijk genetisch worden gemodificeerd met behulp van het genbewerkingshulpmiddel CRISPR (geclusterde, regelmatig op afstand gelegen korte palindromische herhalingen) en CRISPR-geassocieerd eiwit 9 (Cas9) en waren relatief eenvoudig te kweken.
Referentie:
- Tanaka, J., Senpuku, H., Ogawa, M. et al. Vom Menschen induzierte pluripotente, aus Stammzellen gewonnene Speicheldrüsenorganoide modellieren die SARS-CoV-2-Infektion und -Replikation. Nat Cell Biol (2022). https://doi.org/10.1038/s41556-022-01007-6, https://www.nature.com/articles/s41556-022-01007-6#Sec7

 Suche
Suche
 Mein Konto
Mein Konto
