Naukowcy opracowują organoidy ludzkiego gruczołu ślinowego, aby przetestować zakaźność SARS-CoV-2
W niedawnym badaniu opublikowanym w czasopiśmie Nature Cell Biology naukowcy wykazali podatność gruczołów ślinowych na ciężkie zakażenie koronawirusem-2 zespołu ostrej niewydolności oddechowej (SARS-CoV-2) in vitro przy użyciu modelu hodowli organoidów. Badanie: Indukowane przez człowieka pluripotencjalne organoidy gruczołów ślinowych pochodzące z komórek macierzystych modelują infekcję i replikację SARS-CoV-2. Zdjęcie: NIAID Tło Chociaż układ oddechowy, w tym górne drogi oddechowe (URT) i płuca, są głównymi celami wirusa SARS-CoV-2, istnieje coraz więcej dowodów na to, że atakuje on wiele narządów. Na przykład błona śluzowa jamy ustnej i gruczoły ślinowe wykazują szeroką ekspresję dwóch czynników wejścia SARS-CoV-2, enzymu konwertującego angiotensynę 2 (ACE2) i przezbłonowej proteazy serynowej 2 (TMPRSS2). Służą także jako rezerwuar SARS-CoV-2. …
Naukowcy opracowują organoidy ludzkiego gruczołu ślinowego, aby przetestować zakaźność SARS-CoV-2
W badaniu opublikowanym niedawno w czasopiśmie Naturalna biologia komórki Naukowcy wykazali in vitro podatność gruczołów ślinowych na zakażenie koronawirusem-2 (SARS-CoV-2) ciężkiego ostrego zespołu oddechowego, korzystając z modelu hodowli organoidów.
tło
Chociaż układ oddechowy, w tym górne drogi oddechowe (URT) i płuca, są głównymi celami wirusa SARS-CoV-2, istnieje coraz więcej dowodów na to, że atakuje on wiele narządów. Na przykład błona śluzowa jamy ustnej i gruczoły ślinowe wykazują szeroką ekspresję dwóch czynników wejścia SARS-CoV-2, enzymu konwertującego angiotensynę 2 (ACE2) i przezbłonowej proteazy serynowej 2 (TMPRSS2). Służą także jako rezerwuar SARS-CoV-2.
Co ciekawe, 80% zakażeń SARS-CoV-2 przebiega bezobjawowo. Ponadto badania wykazały, że wirus SARS-CoV-2 atakuje ludzkie gruczoły ślinowe, a zakaźne wiriony ze śliny osób bezobjawowych przyczyniają się do dalszego przenoszenia wirusa.
Ze względu na zdolność SARS-CoV-2 do infekowania wielu typów organoidów, model hodowli organoidów może okazać się odpowiedni do wykrywania zakażenia SARS-CoV-2 w gruczołach ślinowych (in vitro). Jednak ze względu na brak odpowiednich modeli in vitro w badaniach nie udało się wyjaśnić mechanizmów leżących u podstaw infekcji i replikacji SARS-CoV-2 w gruczołach ślinowych, a następnie wydzielania do śliny.
O badaniu
W niniejszym badaniu badacze wygenerowali funkcjonalne organoidy gruczołów ślinowych z indukowanych przez człowieka pluripotencjalnych komórek macierzystych (hiPSC) o podobnych cechach morfologicznych i funkcjach fizjologicznych (in vivo) do ludzkich gruczołów ślinowych. Co więcej, te organoidy miały linie komórkowe specyficzne dla gruczołów ślinowych.
Zespół przeprowadził sekwencjonowanie kwasu rybonukleinowego pojedynczych komórek (scRNA-seq) komórek hiSG w 80. dniu przy użyciu platformy 10X Genomics. Ponadto wyizolowali organoidy w 60. dniu i hodowali je z czynnikiem wzrostu fibroblastów (FGF) 7 i 10 do 80. dnia, aby scharakteryzować zaobserwowane struktury rozgałęziające.
Gen czynnika transkrypcyjnego 9 SRY-box (SOX9) reguluje rozwój gruczołów ślinowych u myszy i ludzi. W przypadku jego braku gruczoły ślinowe nie mogą ulegać morfogenezie rozgałęziającej. Dlatego badacze stłumili SOX9 podczas indukcji hiSG, aby dowiedzieć się, czy hiSG podsumowują proces rozwoju, w którym pośredniczy SOX9.
Wyniki badań
Wywołane przez człowieka gruczoły ślinowe (hiSG) miały podobne właściwości do embrionalnych gruczołów ślinowych, w tym cechy morfologiczne, ekspresję markerów białkowych i charakterystykę ekspresji genów. Zgodnie z badaniami in vivo przeprowadzonymi na myszach, knockdown SOX9 hamuje tworzenie rozgałęzień w hiPSC, co sugeruje, że gen ten ma kluczowe znaczenie dla rozwoju ludzkiego gruczołu ślinowego. Zatem ten model badawczy mógłby zastąpić modele zwierzęce wykorzystywane do badania rozwoju ludzkich gruczołów ślinowych.
HiSG morfologicznie i funkcjonalnie naśladują naturalne gruczoły ślinowe. Bezstronne grupowanie sekwencji scRNA pozwoliło zidentyfikować sześć głównych grup komórek, które można dalej podzielić na podtypy komórkowe. Mała populacja mezenchymalna w HiSG nie wykazywała cech mezenchymu gruczołów ślinowych. Natomiast grupa komórek nabłonkowych składała się z pięciu grup komórek: komórek groniastych, podstawnych, przewodowych, mioepitelialnych i komórek aktywnie cyklicznych. HiSG obejmowały niezależne linie podstawowych komórek mioepitelialnych z linii przewodowo-zrazikowej, a analiza pseudoczasowa wykazała różnice między tymi dwiema liniami komórkowymi.
Podstawową funkcją gruczołów ślinowych jest wydzielanie płynu indukowanego acetylocholiną poprzez szlaki muskarynowego receptora acetylocholiny. W przypadku hiSG leczenie karbacholem, agonistą muskarynowego receptora acetylocholiny, powodowało przemijające i zależne od dawki zwiększenie wewnątrzkomórkowego stężenia wapnia. Co więcej, ortotopowo przeszczepione hiSG wykazywały z biegiem czasu fenotyp dojrzałych gruczołów ślinowych przeszczepionych myszom do miejsca biorcy.
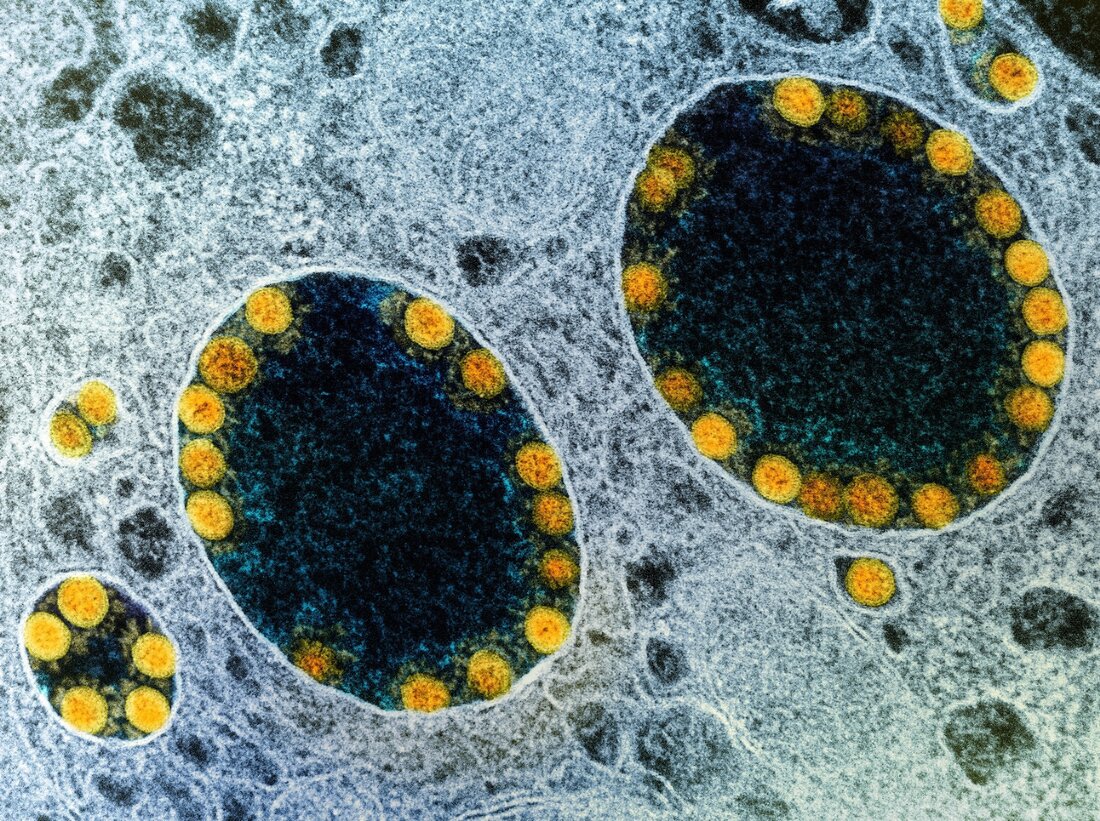
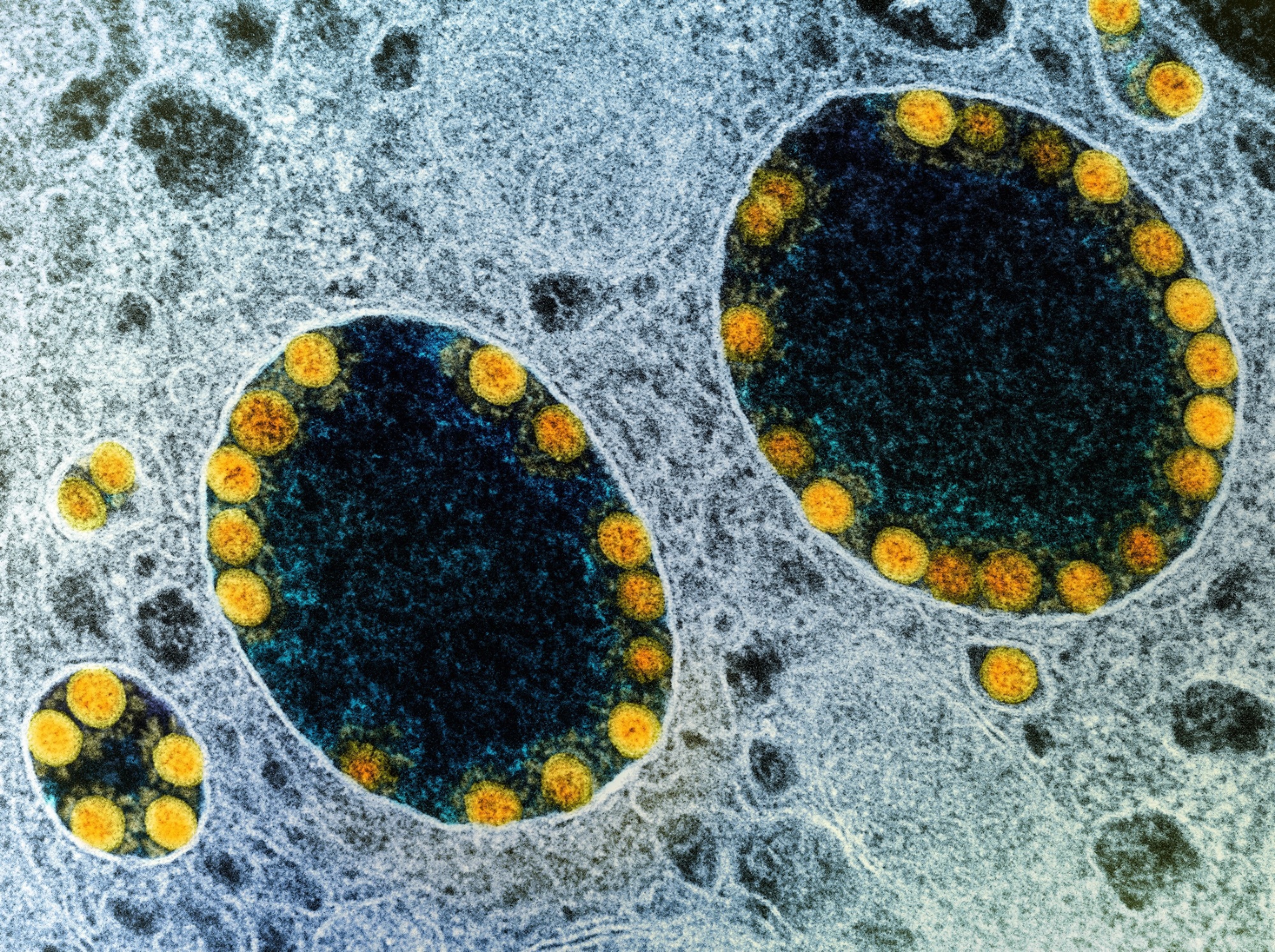
Analizy scRNA-seq i analizy immunofluorescencyjne wykazały również, że komórki przewodowe w obrębie hiSG obficie wyrażały ACE2 i TMPRSS2, podobnie jak w normalnych gruczołach ślinowych. Metoda barwienia immunologicznego ujawniła, że chociaż komórki przewodowe po wierzchołkowej stronie hiSG silnie wyrażały ACE2, komórki przewodowe i komórki groniaste wyrażały TMPRSS2. Po kontakcie z SARS-CoV-2 hiSG zostały zakażone i wykazywały replikację SARS-CoV-2 w ciągu 24 godzin od zakażenia. Autorzy odkryli także nukleoproteinę SARS-CoV-2 w zakażonych komórkach przewodowych. W związku z tym test hodowli tkankowej o średniej zakaźności (TCID50) wykazał zakaźne wirusy w hiSG, których szczyt występował po 24 godzinach, ale później spadł.
Wnioski
W rzeczywistości hiSG opracowane w bieżącym badaniu mogą służyć jako cenny model reprodukcji heterogenicznych populacji komórek w ludzkich gruczołach ślinowych. Co więcej, hiSG mogą wspierać analizę funkcjonalną genów podczas rozwoju i służyć jako obiecujące narzędzie do badania infekcji SARS-CoV-2 w gruczołach ślinowych na poziomie molekularnym. Ponadto naukowcy wykazali, że hiSG mają kilka zalet w porównaniu z organoidami pochodzącymi z tkankowych komórek progenitorowych macierzystych gruczołów ślinowych dorosłego człowieka. Na przykład można je było łatwo modyfikować genetycznie przy użyciu narzędzia do edycji genów CRISPR (skupione regularnie rozmieszczone krótkie powtórzenia palindromowe) i białka 9 powiązanego z CRISPR (Cas9), a hodowanie było stosunkowo łatwe.
Odniesienie:
- Tanaka, J., Senpuku, H., Ogawa, M. et al. Vom Menschen induzierte pluripotente, aus Stammzellen gewonnene Speicheldrüsenorganoide modellieren die SARS-CoV-2-Infektion und -Replikation. Nat Cell Biol (2022). https://doi.org/10.1038/s41556-022-01007-6, https://www.nature.com/articles/s41556-022-01007-6#Sec7

 Suche
Suche
 Mein Konto
Mein Konto
