Vedci vyvíjajú organoidy ľudských slinných žliaz na testovanie infekčnosti SARS-CoV-2
V nedávnej štúdii publikovanej v časopise Nature Cell Biology výskumníci preukázali náchylnosť slinných žliaz na závažnú infekciu akútnym respiračným syndrómom koronavírus-2 (SARS-CoV-2) in vitro pomocou modelu organoidnej kultúry. Štúdia: Model infekcie a replikácie SARS-CoV-2 z organoidov slinných žliaz pochádzajúcich z pluripotentných kmeňových buniek. Obrazový kredit: NIAID Pozadie Hoci dýchací systém vrátane horných dýchacích ciest (URT) a pľúc sú primárnymi cieľmi SARS-CoV-2, pribúdajú dôkazy o tom, že postihuje viaceré orgány. Napríklad ústna sliznica a slinné žľazy široko exprimujú dva vstupné faktory SARS-CoV-2, enzým konvertujúci angiotenzín 2 (ACE2) a transmembránovú serínovú proteázu 2 (TMPRSS2). Slúžia aj ako rezervoár pre SARS-CoV-2. …
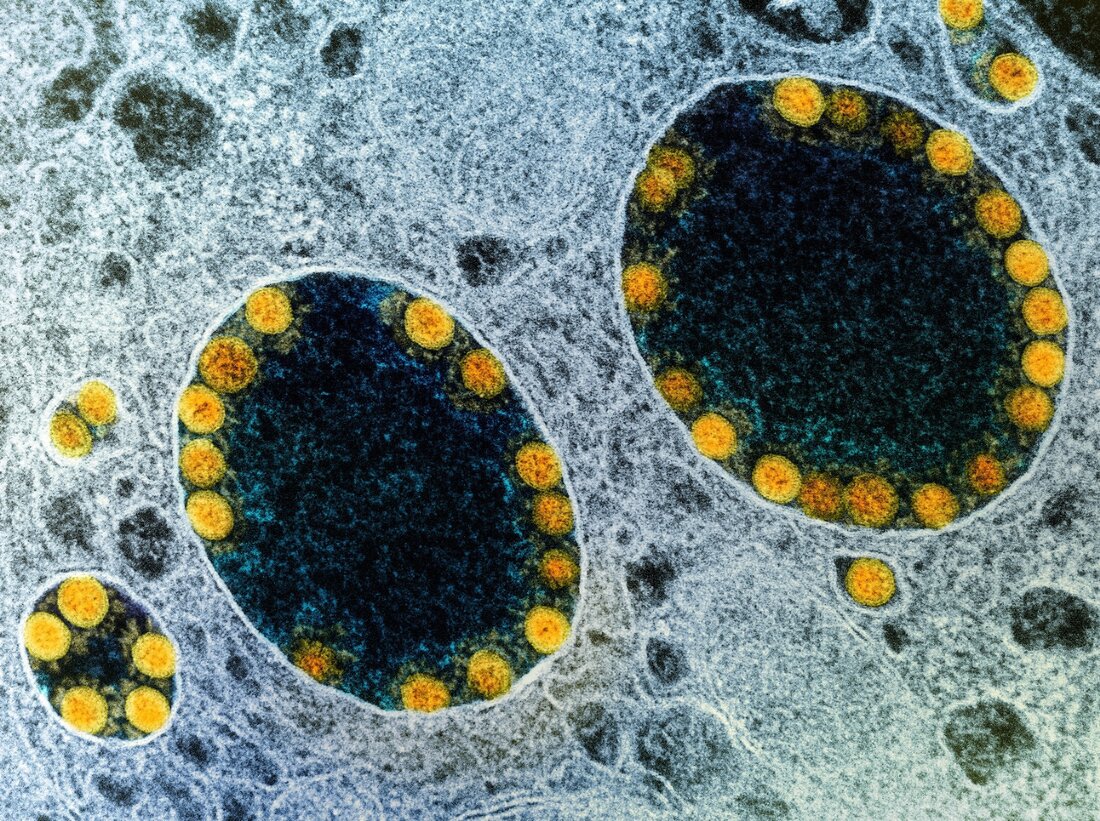
Vedci vyvíjajú organoidy ľudských slinných žliaz na testovanie infekčnosti SARS-CoV-2
V štúdii nedávno publikovanej v časopise Prirodzená bunková biológia Výskumníci in vitro preukázali citlivosť slinných žliaz na infekciu koronavírusom-2 (SARS-CoV-2) závažného akútneho respiračného syndrómu pomocou modelu organoidnej kultúry.
pozadia
Hoci dýchací systém vrátane horných dýchacích ciest (URT) a pľúc sú hlavnými cieľmi SARS-CoV-2, pribúdajú dôkazy o tom, že postihuje viaceré orgány. Napríklad ústna sliznica a slinné žľazy široko exprimujú dva vstupné faktory SARS-CoV-2, enzým konvertujúci angiotenzín 2 (ACE2) a transmembránovú serínovú proteázu 2 (TMPRSS2). Slúžia aj ako rezervoár pre SARS-CoV-2.
Je zaujímavé, že 80 % infekcií SARS-CoV-2 je asymptomatických. Štúdie navyše uvádzajú, že SARS-CoV-2 sa zameriava na ľudské slinné žľazy a infekčné virióny zo slín asymptomatických jedincov prispievajú k ďalšiemu prenosu vírusu.
Vzhľadom na schopnosť SARS-CoV-2 infikovať viaceré typy organoidov sa model organoidnej kultúry môže ukázať ako vhodný na detekciu infekcie SARS-CoV-2 v slinných žľazách (in vitro). V dôsledku nedostatku vhodných modelov in vitro však štúdie nedokázali objasniť mechanizmy, ktoré sú základom infekcie a replikácie SARS-CoV-2 v slinných žľazách a následnej sekrécie do slín.
O štúdiu
V tejto štúdii výskumníci vytvorili funkčné organoidy slinných žliaz z pluripotentných kmeňových buniek (hiPSC) indukovaných ľuďmi s podobnými morfologickými vlastnosťami a fyziologickými funkciami (in vivo) ako ľudské slinné žľazy. Okrem toho tieto organoidy mali bunkové línie špecifické pre slinné žľazy.
Tím vykonal jednobunkové sekvenovanie ribonukleovej kyseliny (scRNA-seq) buniek hiSG v deň 80 pomocou platformy 10X Genomics. Okrem toho izolovali organoidy v deň 60 a kultivovali ich s fibroblastovým rastovým faktorom (FGF) 7 a 10 až do dňa 80, aby charakterizovali pozorované štruktúry vetvenia.
Gén SRY-box transkripčného faktora 9 (SOX9) reguluje vývoj slinných žliaz u myší a ľudí. V jeho neprítomnosti nemôžu slinné žľazy prejsť morfogenézou vetvenia. Preto výskumníci potlačili SOX9 počas indukcie hiSG, aby zistili, či hiSG rekapitulovali proces vývoja sprostredkovaný SOX9.
Výsledky štúdie
Slinné žľazy indukované človekom (hiSG) mali podobné vlastnosti ako embryonálne slinné žľazy, vrátane morfologických charakteristík, expresie proteínových markerov a charakteristík génovej expresie. V súlade so štúdiami in vivo vykonanými na myšiach knockdown SOX9 inhiboval tvorbu vetiev v hiPSC, čo naznačuje, že tento gén je rozhodujúci pre vývoj ľudských slinných žliaz. Tento študijný model by teda mohol nahradiť zvieracie modely používané na štúdium vývoja ľudských slinných žliaz.
hiSG morfologicky a funkčne napodobňovali prirodzené slinné žľazy. Nestranné zhlukovanie scRNA-seq identifikovalo šesť hlavných bunkových skupín, ktoré sú ďalej deliteľné na bunkové podtypy. Malá mezenchymálna populácia v HiSG nevykazovala znaky mezenchýmu slinných žliaz. Na rozdiel od toho skupina epitelových buniek pozostávala z piatich bunkových skupín: acinárne, bazálne, duktálne, myoepiteliálne a aktívne cyklujúce bunky. hiSG obsahovali nezávislé línie bazálnych myoepiteliálnych buniek z duktálno-acinárnej línie a pseudočasová analýza preukázala rozdiely medzi týmito dvoma bunkovými líniami.
Základnou funkciou slinných žliaz je sekrécia acetylcholínom indukovanej tekutiny prostredníctvom muskarínových acetylcholínových receptorových dráh. Pri hiSG liečba karbacholom, agonistom muskarínového acetylcholínového receptora, viedla k prechodnému a na dávke závislému zvýšeniu intracelulárnych hladín vápnika. Okrem toho ortotopicky transplantované hiSG vykazovali fenotyp zrelých slinných žliaz transplantovaných do miesta príjemcu u myší v priebehu času.
Analýzy scRNA-seq a imunofluorescencie tiež ukázali, že duktálne bunky v hiSG hojne exprimovali ACE2 a TMPRSS2, podobne ako normálne slinné žľazy. Metóda imunofarbenia odhalila, že hoci duktálne bunky na apikálnej strane hiSG silne exprimovali ACE2, duktálne bunky a acinárne bunky exprimovali TMPRSS2. Po kontakte so SARS-CoV-2 sa hiSG infikovali a vykazovali replikáciu SARS-CoV-2 do 24 hodín od infekcie. Autori tiež objavili nukleoproteín SARS-CoV-2 v infikovaných duktálnych bunkách. V súlade s tým test strednej infekčnej tkanivovej kultúry (TCID50) ukázal infekčné vírusy v hiSG, ktoré dosiahli vrchol po 24 hodinách, ale neskôr sa znížili.
Závery
V skutočnosti by hiSG vyvinuté v súčasnej štúdii mohli slúžiť ako cenný model pre reprodukciu heterogénnych bunkových populácií v ľudských slinných žľazách. Okrem toho by hiSG mohli podporovať funkčnú analýzu génov počas vývoja a slúžiť ako sľubný nástroj na štúdium infekcií SARS-CoV-2 v slinných žľazách na molekulárnej úrovni. Okrem toho výskumníci ukázali, že hiSG má niekoľko výhod v porovnaní s organoidmi odvodenými z tkanivových kmeňových progenitorových buniek zo slinných žliaz dospelých ľudí. Napríklad by sa dali ľahko geneticky modifikovať pomocou nástroja na úpravu génov CRISPR (zoskupené pravidelne rozmiestnené krátke palindromické opakovania) a proteín 9 spojený s CRISPR (Cas9) a relatívne ľahko sa kultivovali.
Referencia:
- Tanaka, J., Senpuku, H., Ogawa, M. et al. Vom Menschen induzierte pluripotente, aus Stammzellen gewonnene Speicheldrüsenorganoide modellieren die SARS-CoV-2-Infektion und -Replikation. Nat Cell Biol (2022). https://doi.org/10.1038/s41556-022-01007-6, https://www.nature.com/articles/s41556-022-01007-6#Sec7

 Suche
Suche
 Mein Konto
Mein Konto
