Χαρακτηριστικά του Καρκίνου: Νέες Διαστάσεις
Πρόλογος The Hallmarks of Cancer Conceptualization είναι ένα ευρετικό εργαλείο για την απόσταξη της τεράστιας πολυπλοκότητας των φαινοτύπων και των γονότυπων του καρκίνου σε ένα προκαταρκτικό σύνολο υποκείμενων αρχών. Καθώς η γνώση των μηχανισμών του καρκίνου έχει προχωρήσει, άλλες πτυχές της νόσου έχουν εμφανιστεί ως πιθανές βελτιώσεις. Αυτό δημιουργεί την προοπτική ότι η φαινοτυπική πλαστικότητα και η διαταραγμένη διαφοροποίηση είναι μια ξεχωριστή χαρακτηριστική ικανότητα και ότι ο μη μεταλλαγμένος επιγενετικός επαναπρογραμματισμός και τα πολυμορφικά μικροβιώματα αντιπροσωπεύουν και οι δύο χαρακτηριστικές ιδιότητες που διευκολύνουν την απόκτηση χαρακτηριστικών ικανοτήτων. Επιπλέον, γηρασμένα κύτταρα διαφορετικής προέλευσης μπορούν να προστεθούν στον κατάλογο των λειτουργικά σημαντικών τύπων κυττάρων στο μικροπεριβάλλον του όγκου. Σημαίνει ότι ο καρκίνος είναι τρομακτικός σε...

Χαρακτηριστικά του Καρκίνου: Νέες Διαστάσεις
Πρόλογος
Το Hallmarks of Cancer Conceptualization είναι ένα ευρετικό εργαλείο για την απόσταξη της τεράστιας πολυπλοκότητας των φαινοτύπων και των γονότυπων του καρκίνου σε ένα προκαταρκτικό σύνολο βασικών αρχών. Καθώς η γνώση των μηχανισμών του καρκίνου έχει προχωρήσει, άλλες πτυχές της νόσου έχουν εμφανιστεί ως πιθανές βελτιώσεις. Αυτό δημιουργεί την προοπτική ότι η φαινοτυπική πλαστικότητα και η διαταραγμένη διαφοροποίηση είναι μια ξεχωριστή χαρακτηριστική ικανότητα και ότι ο μη μεταλλαγμένος επιγενετικός επαναπρογραμματισμός και τα πολυμορφικά μικροβιώματα αντιπροσωπεύουν και οι δύο χαρακτηριστικές ιδιότητες που διευκολύνουν την απόκτηση χαρακτηριστικών ικανοτήτων. Επιπλέον, γηρασμένα κύτταρα διαφορετικής προέλευσης μπορούν να προστεθούν στον κατάλογο των λειτουργικά σημαντικών τύπων κυττάρων στο μικροπεριβάλλον του όγκου.
Εννοια
Ο καρκίνος είναι τρομακτικός ως προς το εύρος και το εύρος της ποικιλομορφίας του, που περιλαμβάνει τη γενετική, τη βιολογία των κυττάρων και των ιστών, την παθολογία και την ανταπόκριση στη θεραπεία. Τα ολοένα και πιο ισχυρά πειραματικά και υπολογιστικά εργαλεία και τεχνολογίες παρέχουν μια χιονοστιβάδα «μεγάλων δεδομένων» σχετικά με τις μυριάδες εκδηλώσεις ασθενειών που περιλαμβάνει ο καρκίνος. Η ολοκληρωμένη ιδέα που ενσωματώνεται στα χαρακτηριστικά του καρκίνου βοηθά στην απόσταξη αυτής της πολυπλοκότητας σε μια ολοένα και πιο λογική επιστήμη και οι προκαταρκτικές νέες διαστάσεις που παρουσιάζονται σε αυτήν την προοπτική μπορούν να προσθέσουν αξία σε αυτήν την προσπάθεια για την καλύτερη κατανόηση των μηχανισμών καρκινογένεσης και κακοήθους εξέλιξης και την εφαρμογή αυτής της γνώσης στην ιατρική του καρκίνου.
εισαγωγή
Τα Χαρακτηριστικά του Καρκίνου έχουν προταθεί ως ένα σύνολο λειτουργικών ικανοτήτων που αποκτούν τα ανθρώπινα κύτταρα καθώς περνούν από την κανονικότητα σε νεοπλασματικές καταστάσεις ανάπτυξης, πιο συγκεκριμένα ικανότητες κρίσιμες για την ικανότητά τους να σχηματίζουν κακοήθεις όγκους. Σε αυτά τα άρθρα ( 1, 2 ), ο Bob Weinberg και εγώ αναφέραμε αυτά που οραματιστήκαμε ως κοινά σημεία που ενοποιούν όλους τους τύπους καρκινικών κυττάρων στο επίπεδο του κυτταρικού φαινοτύπου. Η πρόθεση ήταν να παράσχει ένα εννοιολογικό πλαίσιο που θα επέτρεπε τον εξορθολογισμό των πολύπλοκων φαινοτύπων διαφορετικών τύπων και παραλλαγών ανθρώπινου όγκου σε σχέση με ένα κοινό σύνολο υποκείμενων κυτταρικών παραμέτρων. Αρχικά, οραματιστήκαμε τη συμπληρωματική συμπερίληψη έξι διαφορετικών δυνατοτήτων επωνυμίας και αργότερα επεκτείναμε αυτόν τον αριθμό σε οκτώ.
Αυτό το σκεύασμα επηρεάστηκε από την αναγνώριση ότι οι ανθρώπινοι καρκίνοι αναπτύσσονται ως προϊόντα διεργασιών πολλαπλών σταδίων και ότι η απόκτηση αυτών των λειτουργικών ικανοτήτων θα μπορούσε να αποδοθεί κατά κάποιο τρόπο στα διαφορετικά στάδια της παθογένεσης του όγκου. Η ποικιλομορφία της κακοήθους παθογένεσης, που περιλαμβάνει πολλαπλούς τύπους όγκων και μια αυξανόμενη πληθώρα υποτύπων, περιλαμβάνει διάφορες εκτροπές (και επομένως επίκτητες ικανότητες και ιδιότητες) που είναι αποτέλεσμα ειδικών ιστικών φραγμών που αναγκαστικά παρακάμπτονται κατά τη διάρκεια ορισμένων οδών ογκογένεσης. Αν και αναγνωρίζουμε ότι τέτοιοι εξειδικευμένοι μηχανισμοί μπορεί να είναι χρήσιμοι, έχουμε περιορίσει τον προσδιορισμό των χαρακτηριστικών σε παραμέτρους που έχουν ευρεία επίδραση σε όλο το φάσμα των ανθρώπινων καρκίνων.
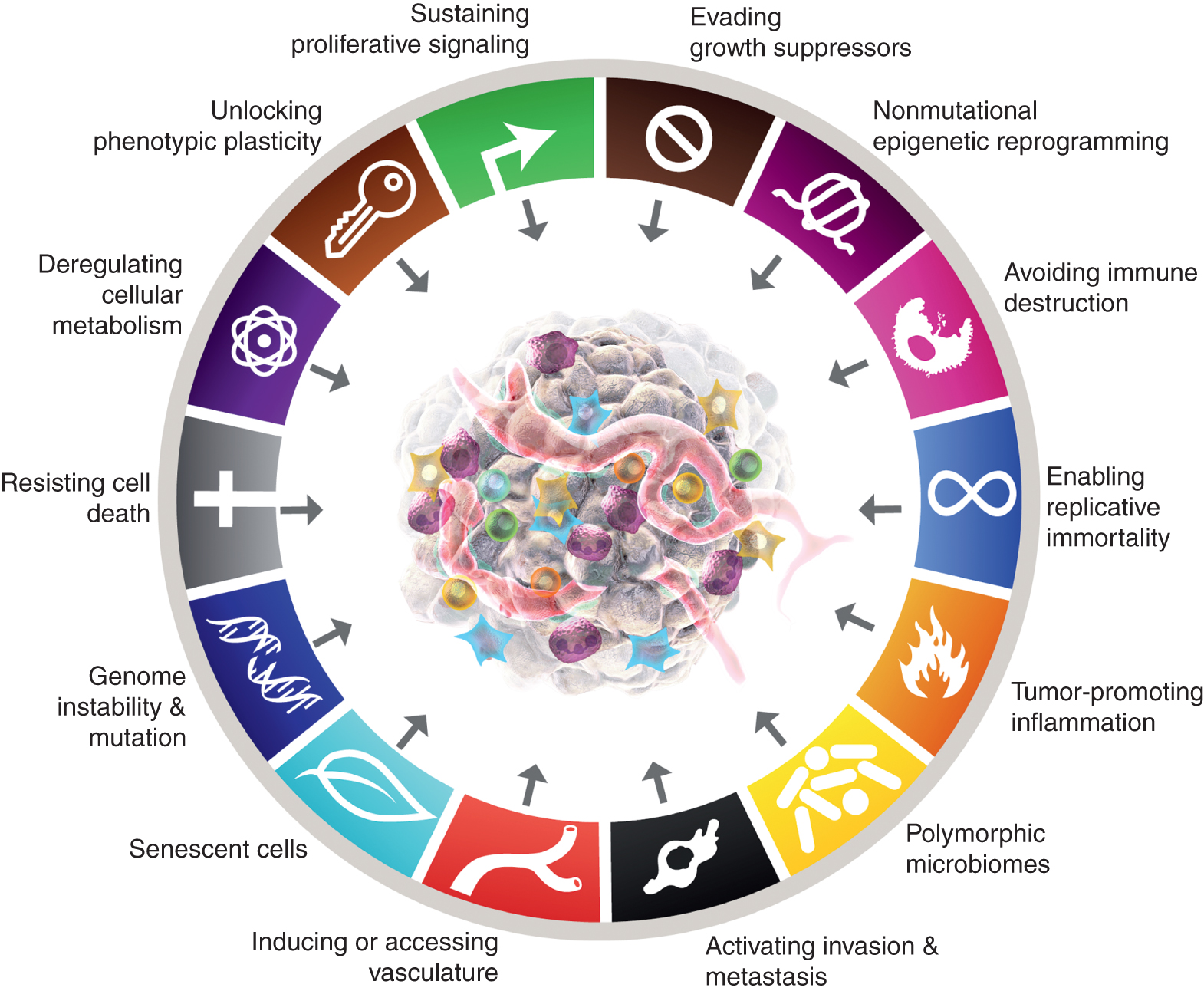
Τα οκτώ χαρακτηριστικά περιλαμβάνουν επί του παρόντος (Εικ.1, αριστερά) τις επίκτητες ικανότητες διατήρησης της πολλαπλασιαστικής σηματοδότησης, αποφυγής καταστολέων ανάπτυξης, αντίστασης στον κυτταρικό θάνατο, ενεργοποίησης της αναπαραγόμενης αθανασίας, πρόκλησης/πρόσβασης αγγείων, ενεργοποίησης εισβολής και μετάστασης, επαναπρογραμματισμού κυτταρικού μεταβολισμού και αποφυγής καταστροφής του ανοσοποιητικού συστήματος. Στην πιο πρόσφατη επεξεργασία αυτής της έννοιας (2), η απορρύθμιση του κυτταρικού μεταβολισμού και η αποφυγή της καταστροφής του ανοσοποιητικού συστήματος οριοθετήθηκαν ως «αναδυόμενα χαρακτηριστικά», αλλά τώρα, έντεκα χρόνια αργότερα, είναι προφανές ότι, παρόμοια με τα αρχικά έξι, μπορούν να θεωρηθούν βασικά χαρακτηριστικά του καρκίνου και περιλαμβάνονται ως τέτοια στην τρέχουσα αφήγηση (Εικ. 1, αριστερά).
Εικόνα 1
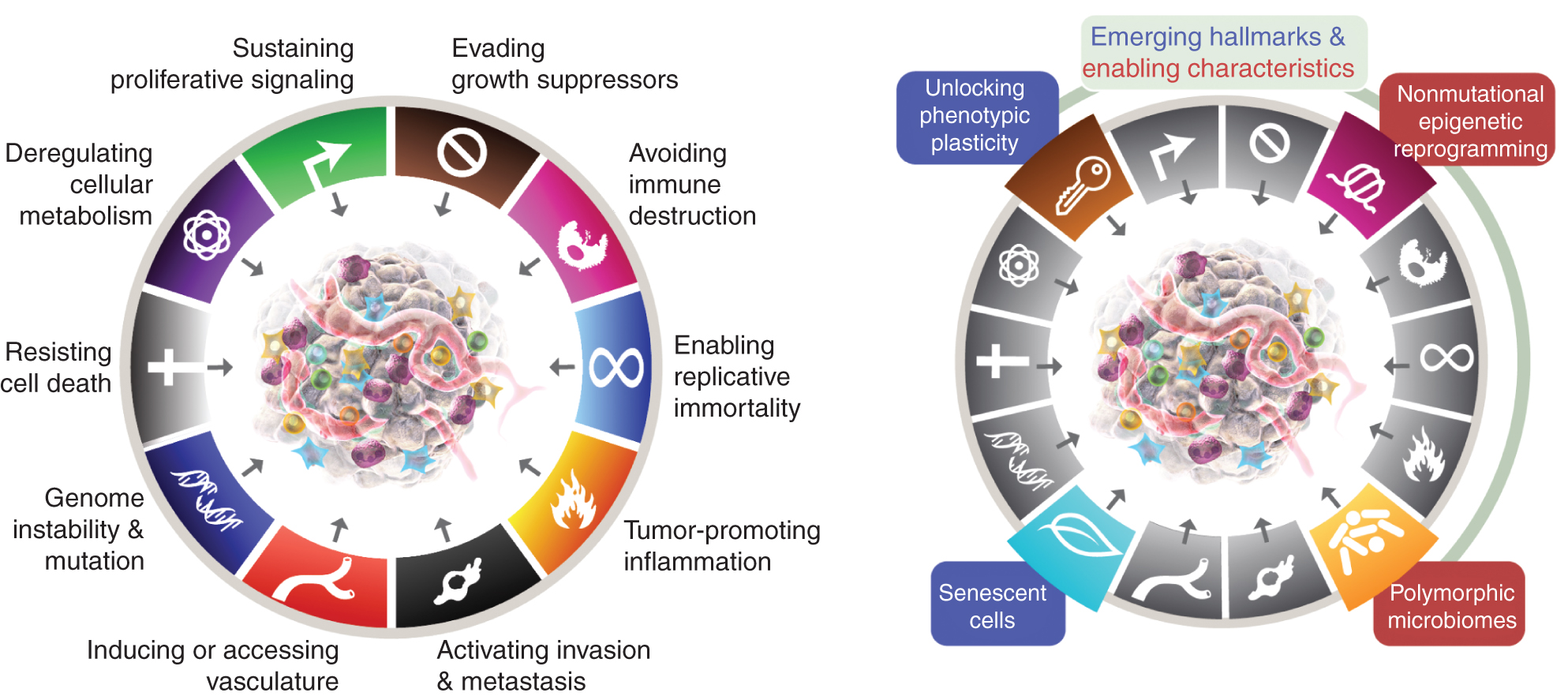
Τα χαρακτηριστικά του Καρκίνου σήμερα ενσωματώνουν οκτώ διακριτικές ικανότητες και δύο υποστηρικτικές ιδιότητες. Εκτός από τις έξι αποκτηθείσες ικανότητες - χαρακτηριστικά του καρκίνου - που προτάθηκαν το 2000 (1), τα δύο προκαταρκτικά "αναδυόμενα χαρακτηριστικά γνωρίσματα" που εισήχθησαν το 2011 (2) - η κυτταρική ενέργεια (τώρα πιο συχνά αναφέρεται ως "επαναπρογραμματισμός του κυτταρικού μεταβολισμού") και η "αποφυγή του ανοσοποιητικού πυρήνα" έχουν θεωρηθεί επαρκώς έγκυρη ως μέρος της καταστροφής του ανοσοποιητικού".
Δεδομένης της αυξανόμενης αναγνώρισης ότι οι όγκοι μπορούν να αγγειωθούν επαρκώς, είτε ενεργοποιώντας την αγγειογένεση είτε επιλέγοντας την αγγείωση του φυσιολογικού ιστού (128), αυτό το χαρακτηριστικό ορίζεται επίσης ευρύτερα ως η ικανότητα πρόκλησης ή με άλλο τρόπο πρόσβασης σε αγγεία που υποστηρίζουν την ανάπτυξη όγκου κυρίως μέσω εισβολής και μετάστασης.
Η συνέχεια του 2011 περιελάμβανε επίσης τη «φλεγμονή που προάγει τον όγκο» ως δεύτερο χαρακτηριστικό, που συμπληρώνει την κυρίαρχη «αστάθεια και μετάλλαξη του γονιδιώματος», που μαζί συμμετείχαν θεμελιωδώς στην ενεργοποίηση των οκτώ χαρακτηριστικών (λειτουργικών) δυνατοτήτων που απαιτούνται για την ανάπτυξη και την εξέλιξη του όγκου. Είναι αλήθεια ότι αυτή η ανασκόπηση περιλαμβάνει πρόσθετα προτεινόμενα νέα χαρακτηριστικά και χαρακτηριστικά ενεργοποίησης, όπως «ξεκλείδωμα φαινοτυπικής πλαστικότητας», «μη μεταλλαγμένος επιγενετικός επαναπρογραμματισμός», «πολυμορφικά μικροβιώματα» και «γερασμένα κύτταρα». Τα εμπορικά σήματα του γραφικού καρκίνου υιοθετήθηκαν από τους Hanahan και Weinberg (2).
Όπως σημειώσαμε τότε, αυτά τα διακριτικά χαρακτηριστικά από μόνα τους δεν μπορούν να αντιμετωπίσουν την πολυπλοκότητα της παθογένεσης του καρκίνου, δηλαδή h. τους ακριβείς μοριακούς και κυτταρικούς μηχανισμούς που επιτρέπουν στα αναπτυσσόμενα προνεοπλασματικά κύτταρα να αναπτύξουν και να αποκτήσουν αυτές τις ανώμαλες φαινοτυπικές ικανότητες κατά τη διάρκεια της ογκογένεσης και της κακοήθους εξέλιξης.
Συνεπώς, προσθέσαμε μια άλλη έννοια στη συζήτηση που παρουσιάζεται ως «ενεργοποιητικά χαρακτηριστικά», συνέπειες της ανώμαλης κατάστασης του νεοπλάσματος που παρέχουν τα μέσα με τα οποία τα καρκινικά κύτταρα και οι όγκοι μπορούν να αποκτήσουν αυτά τα λειτουργικά χαρακτηριστικά. Ως εκ τούτου, οι ενθαρρυντικές ιδιότητες αντανακλώνται στους μοριακούς και κυτταρικούς μηχανισμούς μέσω των οποίων αποκτώνται τα χαρακτηριστικά γνωρίσματα, παρά στις ίδιες τις οκτώ παραπάνω δεξιότητες. Αυτές οι δύο διαδικασίες ενεργοποίησης ήταν η αστάθεια του γονιδιώματος και η φλεγμονή που προάγει τον όγκο.
Αναγνωρίσαμε περαιτέρω ότι το μικροπεριβάλλον όγκου (TME), που ορίζεται εδώ ως αποτελούμενο από ετερογενείς και αλληλεπιδραστικούς πληθυσμούς καρκινικών κυττάρων και καρκινικών βλαστοκυττάρων μαζί με μια ποικιλία στρατολογημένων τύπων στρωματικών κυττάρων - το μετασχηματισμένο παρέγχυμα και το σχετικό στρώμα - θεωρείται πλέον ευρέως ότι παίζει ουσιαστικό ρόλο στην ογκογένεση και την κακοήθη εξέλιξη.
Δεδομένου του συνεχούς ενδιαφέροντος για αυτές τις διατυπώσεις και της συνεχιζόμενης πρόθεσής μας να ενθαρρύνουμε τη συνεχή συζήτηση και τη βελτίωση του σχήματος των Χαρακτηριστικών, είναι σκόπιμο να εξετάσουμε μια συχνή ερώτηση: Υπάρχουν πρόσθετα χαρακτηριστικά αυτού του εννοιολογικού μοντέλου που θα μπορούσαν να ενσωματωθούν, λαμβάνοντας υπόψη την ανάγκη διασφάλισης αυτού; ότι ισχύουν ευρέως σε όλο το φάσμα των ανθρώπινων καρκίνων; Ως εκ τούτου, παρουσιάζω πολλά πιθανά νέα χαρακτηριστικά γνωρίσματα και δυνατότητες που θα μπορούσαν, σε εύθετο χρόνο, να ενσωματωθούν ως βασικά στοιχεία των χαρακτηριστικών της εννοιοποίησης του καρκίνου.
Αυτές οι παράμετροι είναι «ξεκλείδωμα της φαινοτυπικής πλαστικότητας», «μη μεταλλαγμένος επιγενετικός επαναπρογραμματισμός», «πολυμορφικά μικροβιώματα» και «γηρασμένα κύτταρα» (Εικ. 1, Δεξιά). Είναι σημαντικό ότι τα παραδείγματα που παρουσιάζονται για την υποστήριξη αυτών των διατριβών είναι ενδεικτικά αλλά σε καμία περίπτωση περιεκτικά, καθώς υπάρχει ένας αυξανόμενος και ολοένα και πιο συναρπαστικός όγκος δημοσιευμένων στοιχείων που υποστηρίζουν κάθε βινιέτα.
Χτυπώντας τη φαινοτυπική πλαστικότητα
Κατά τη διάρκεια της οργανογένεσης, η ανάπτυξη, ο προσδιορισμός και η οργάνωση των κυττάρων σε ιστούς για την εκτέλεση ομοιοστατικών λειτουργιών συνοδεύεται από τελική διαφοροποίηση, με τα προγονικά κύτταρα να παύουν να αναπτύσσονται, μερικές φορές μη αναστρέψιμα, καθώς αυτές οι διεργασίες κορυφώνονται. Ως εκ τούτου, το τελικό αποτέλεσμα της κυτταρικής διαφοροποίησης είναι, στις περισσότερες περιπτώσεις, αντιπολλαπλασιαστικό, σχηματίζοντας ένα σαφές εμπόδιο στον συνεχή πολλαπλασιασμό που είναι απαραίτητος για τη νεοπλασία.
Υπάρχουν αυξανόμενες ενδείξεις ότι το ξεκλείδωμα της κανονικά περιορισμένης ικανότητας για φαινοτυπική πλαστικότητα για παράκαμψη ή διαφυγή της κατάστασης τερματικής διαφοροποίησης είναι ένα κρίσιμο συστατικό της παθογένεσης του καρκίνου ( 3 ). Αυτή η πλαστικότητα μπορεί να δράσει σε διάφορες εκδηλώσεις (Εικ. 2). Έτσι, τα εκκολαπτόμενα καρκινικά κύτταρα που προέρχονται από ένα φυσιολογικό κύτταρο που έχει εξελιχθεί κατά μήκος μιας διαδρομής που προσεγγίζει ή αναλαμβάνει μια πλήρως διαφοροποιημένη κατάσταση μπορούν να αντιστρέψουν την πορεία τους αποδιαφοροποιώντας πίσω σε καταστάσεις που μοιάζουν με προγονικά κύτταρα.
Αντίθετα, τα νεοπλασματικά κύτταρα που προκύπτουν από ένα προγονικό κύτταρο που προορίζεται να ακολουθήσει μια οδό που οδηγεί στην τερματική διαφοροποίηση μπορεί να βραχυκυκλώσει τη διαδικασία και να διατηρήσει τα επεκτεινόμενα καρκινικά κύτταρα σε μια μερικώς διαφοροποιημένη, προγονική κατάσταση. Εναλλακτικά, μπορεί να συμβεί διαδιαφοροποίηση κατά την οποία κύτταρα αρχικά δεσμευμένα σε ένα μονοπάτι διαφοροποίησης αλλάζουν σε ένα εντελώς διαφορετικό αναπτυξιακό πρόγραμμα και έτσι αποκτούν ειδικά για τον ιστό χαρακτηριστικά που δεν είχαν προκαθοριστεί από τα φυσιολογικά κύτταρα προέλευσής τους.
Τα ακόλουθα παραδείγματα υποστηρίζουν το επιχείρημα ότι διαφορετικές μορφές κυτταρικής πλαστικότητας αποκαλύπτουν φαινοτυπική πλαστικότητα. Στα αριστερά, η φαινοτυπική πλαστικότητα είναι αναμφισβήτητα μια επίκτητη χαρακτηριστική ικανότητα που επιτρέπει διάφορες διαταραχές της διαφοροποίησης των κυττάρων, συμπεριλαμβανομένης (i) αποδιαφοροποίησης από ώριμες σε προγονικές καταστάσεις, (ii) καθυστερημένης (τελικής) διαφοροποίησης από καταστάσεις προγονικών κυττάρων και (iii) διαδιαφοροποίησης σε άλλες κυτταρικές σειρές. Τρεις εξέχοντες τρόποι μειωμένης διαφοροποίησης που αποτελούν αναπόσπαστο κομμάτι της παθογένεσης του καρκίνου φαίνονται στα δεξιά.
Με τη διαφορική διαστρέβλωση της φυσιολογικής διαφοροποίησης των προγονικών κυττάρων σε ώριμα κύτταρα σε αναπτυξιακές γραμμές, διευκολύνεται η ογκογένεση και η κακοήθης εξέλιξη που προκύπτει από τα κύτταρα προέλευσης σε τέτοιες οδούς. Τα εμπορικά σήματα του γραφικού καρκίνου υιοθετήθηκαν από τους Hanahan και Weinberg (2).
Εικόνα 2

Αποδιαφοροποίηση
Η καρκινογένεση του παχέος εντέρου είναι ένα παράδειγμα εξασθενημένης διαφοροποίησης, καθώς υπάρχει τελολογική ανάγκη για αρχόμενα καρκινικά κύτταρα να ξεφύγουν από τον μεταφορικό ιμάντα της τελικής διαφοροποίησης και απολέπισης, η οποία θα μπορούσε κατ' αρχήν να συμβεί μέσω της αποδιαφοροποίησης των επιθηλιακών κυττάρων του παχέος εντέρου που δεν έχουν ακόμη διαφοροποιηθεί τελικά ή μέσω της καθυστερημένης διαφοροποίησης των προγονικών κυττάρων που δημιουργούν αυτά τα διαφορετικά προγονικά κύτταρα. Τόσο τα διαφοροποιημένα κύτταρα όσο και τα βλαστοκύτταρα έχουν ενοχοποιηθεί ως κύτταρα προέλευσης για τον καρκίνο του παχέος εντέρου (4 – 6).
Δύο αναπτυξιακοί μεταγραφικοί παράγοντες (TF), η πρωτεΐνη homeobox HOXA5 και SMAD4, η τελευταία εμπλέκεται στη σηματοδότηση BMP, εκφράζονται σε μεγάλο βαθμό στα διαφοροποιημένα επιθηλιακά κύτταρα του παχέος εντέρου και συνήθως χάνονται σε προχωρημένα καρκινώματα του παχέος εντέρου, τα οποία εκφράζουν χαρακτηριστικά δείκτες βλαστοκυττάρων και προγονικών κυττάρων. Λειτουργικές διαταραχές σε μοντέλα ποντικιών έδειξαν ότι η αναγκαστική έκφραση του HOXA5 σε καρκινικά κύτταρα του παχέος εντέρου αποκαθιστά τους δείκτες διαφοροποίησης, καταστέλλει τους φαινοτύπους των βλαστοκυττάρων και βλάπτει την εισβολή και τη μετάσταση, παρέχοντας μια λογική για τη χαρακτηριστική μειορρύθμισή του (7, 8).
Αντίθετα, το SMAD4 επιβάλλει τόσο τη διαφοροποίηση όσο και την καταστολή του πολλαπλασιασμού που καθοδηγείται από την ογκογόνο σηματοδότηση WNT, η οποία αποκαλύπτεται από τη μηχανική απώλεια της έκφρασης SMAD4, παρέχοντας μια εξήγηση για την απώλεια έκφρασής του για να επιτρέψει την αποδιαφοροποίηση και, στη συνέχεια, τον υπερπολλαπλασιασμό που βασίζεται σε WNT (5).
Συγκεκριμένα, η απώλεια αυτών των δύο «καταστολέων διαφοροποίησης» με την προκύπτουσα αποδιαφοροποίηση σχετίζεται με την απόκτηση άλλων ικανοτήτων σημάτων, καθώς και άλλων ρυθμιστών που προκαλούν σήματα, περιπλέκοντας τον αυστηρό ορισμό αυτού του προσωρινού σήματος ως διαχωριστικού και ανεξάρτητου.
Μια άλλη σειρά αποδεικτικών στοιχείων αφορά την κατασταλμένη έκφραση του κύριου ρυθμιστή της διαφοροποίησης μελανοκυττάρων MITF, ο οποίος φαίνεται να εμπλέκεται στη γένεση επιθετικών μορφών κακοήθους μελανώματος. Η απώλεια αυτής της αναπτυξιακής TF σχετίζεται με την επανενεργοποίηση των προγονικών γονιδίων της νευρικής ακρολοφίας και τη μείωση της ρύθμισης των γονιδίων που χαρακτηρίζουν τα πλήρως διαφοροποιημένα μελανοκύτταρα. Η επανεμφάνιση των γονιδίων της νευρικής ακρολοφίας δείχνει ότι αυτά τα κύτταρα επιστρέφουν στην προγονική κατάσταση από την οποία προκύπτουν αναπτυξιακά τα μελανοκύτταρα.
Επιπλέον, μια μελέτη ανίχνευσης γενεαλογίας των μελανωμάτων που προκαλούνται από BRAF καθιέρωσε ώριμα μελανοκύτταρα ως κύτταρα προέλευσης που υφίστανται αποδιαφοροποίηση κατά τη διάρκεια της ογκογένεσης ( 9 ). Συγκεκριμένα, το μεταλλαγμένο ογκογονίδιο BRAF, που βρίσκεται σε περισσότερα από τα μισά δερματικά μελανώματα, προκαλεί υπερπολλαπλασιασμό, ο οποίος προηγείται και μπορεί επομένως να διαχωριστεί μηχανικά από την επακόλουθη αποδιαφοροποίηση που προκύπτει από την κατάρρευση του MITF.
Μια άλλη μελέτη ενέπλεξε λειτουργικά την ανοδική ρύθμιση του αναπτυξιακού TF ATF2, του οποίου η χαρακτηριστική έκφραση σε μελανώματα ποντικών και ανθρώπων καταστέλλει έμμεσα το MITF1, ταυτόχρονα με κακοήθη εξέλιξη των κατά συνέπεια αποδιαφοροποιημένων κυττάρων μελανώματος (10). Αντίθετα, η έκφραση σε μελανώματα μεταλλαγμένων μορφών ATF2 που δεν μπορούν να καταστείλουν το MITF έχει ως αποτέλεσμα καλά διαφοροποιημένα μελανώματα (11).
Επιπλέον, μια πρόσφατη μελέτη ( 12 ) έχει συνδέσει την αποδιαφοροποίηση της γενεαλογίας με την κακοήθη εξέλιξη νεοπλασμάτων των κυττάρων των νησιδίων του παγκρέατος με καρκινώματα επιρρεπή σε μεταστάσεις. Αυτά τα νευροενδοκρινικά κύτταρα και οι παράγωγοι όγκοι προκύπτουν από μια αναπτυξιακή γενεαλογία διαφορετική από εκείνη που δημιουργεί τον πολύ μεγαλύτερο αριθμό γειτονικών κυττάρων που σχηματίζουν το εξωκρινές και το πάγκρεας και τα προκύπτοντα αδενοκαρκινώματα του πόρου.
Αξιοσημείωτο είναι ότι η οδός διαφοροποίησης πολλαπλών σταδίων από τα προγονικά κύτταρα των νησιδίων στα ώριμα β-κύτταρα έχει χαρακτηριστεί διεξοδικά (13). Το συγκριτικό προφίλ μεταγραφής δείχνει ότι οι όγκοι των νησίδων που μοιάζουν με αδενώματα είναι περισσότερο παρόμοιοι με τα ανώριμα αλλά διαφοροποιημένα β-κύτταρα που παράγουν ινσουλίνη, ενώ τα διηθητικά καρκινώματα είναι πιο παρόμοια με τους πρόδρομους εμβρυϊκών κυττάρων νησίδων. Η εξέλιξη σε κακώς διαφοροποιημένα καρκινώματα περιλαμβάνει ένα αρχικό στάδιο αποδιαφοροποίησης, το οποίο αρχικά δεν περιλαμβάνει αυξημένο πολλαπλασιασμό ή μειωμένη απόπτωση σε σύγκριση με καλά διαφοροποιημένα αδενώματα, τα οποία τείνουν να εμφανίζονται αργότερα.
Έτσι, το διακριτό βήμα της αποδιαφοροποίησης δεν καθοδηγείται από παρατηρήσιμες αλλαγές στα χαρακτηριστικά γνωρίσματα του παρατεταμένου πολλαπλασιασμού και της αντίστασης στην απόπτωση. Μάλλον, η ανοδική ρύθμιση ενός miRNA που προηγουμένως εμπλέκεται στον προσδιορισμό της προγονικής κατάστασης της νησίδας είναι αυτή που ρυθμίζεται προς τα κάτω κατά τη διάρκεια της τερματικής διαφοροποίησης των β-κυττάρων, 12).
Μπλοκαρισμένη διαφοροποίηση
Ενώ τα παραπάνω παραδείγματα επεξηγούν πώς η καταστολή της έκφρασης του παράγοντα διαφοροποίησης μπορεί να διευκολύνει την ογκογένεση επιτρέποντας σε καλύτερα διαφοροποιημένα κύτταρα να αποδιαφοροποιηθούν σε προγονικά κύτταρα, σε άλλες περιπτώσεις τα ατελώς διαφοροποιημένα προγονικά κύτταρα μπορεί να υποστούν ρυθμιστικές αλλαγές που εμποδίζουν ενεργά την περαιτέρω εξέλιξή τους σε πλήρως διαφοροποιημένες, τυπικά μη πολλαπλασιαστικές καταστάσεις.
Έχει από καιρό τεκμηριωθεί ότι η οξεία προμυελοκυτταρική λευχαιμία (APL) προκύπτει από μια χρωμοσωμική μετατόπιση που συγχωνεύει τη θέση PML στο γονίδιο που κωδικοποιεί τον πυρηνικό υποδοχέα α ρετινοϊκού οξέος (RARα). Τα μυελοειδή προγονικά κύτταρα που φέρουν τέτοιες μετατοπίσεις προφανώς δεν είναι σε θέση να συνεχίσουν τη συνήθη τερματική διαφοροποίησή τους σε κοκκιοκύτταρα, με αποτέλεσμα τα κύτταρα να παγιδεύονται σε ένα πολλαπλασιαστικό προγονικό στάδιο που μοιάζει με προμυελοκύτταρα (14).
Η απόδειξη της ιδέας για αυτό το σχήμα προέρχεται από τη θεραπεία καλλιεργημένων κυττάρων APL, μοντέλων ποντικών της νόσου και προσβεβλημένων ασθενών με ρετινοϊκό οξύ, τον συνδέτη του RARα. Αυτή η θεραπευτική θεραπεία αναγκάζει τα νεοπλασματικά κύτταρα APL να διαφοροποιηθούν σε φαινομενικά ώριμα, μη πολλαπλασιαζόμενα κοκκιοκύτταρα, βραχυκυκλώνοντας έτσι την προοδευτική πολλαπλασιαστική επέκτασή τους (14-16).
Μια παραλλαγή σε αυτό το θέμα αφορά μια άλλη μορφή οξείας μυελογενούς λευχαιμίας, αυτή που φέρει τη μετατόπιση t(8;21) που παράγει την πρωτεΐνη σύντηξης AML1-ETO. Αυτή η πρωτεΐνη από μόνη της μπορεί να μεταμορφώσει τους μυελοειδείς προγόνους, τουλάχιστον εν μέρει εμποδίζοντας τη διαφοροποίησή τους. Θεραπευτική παρέμβαση σε μοντέλα ποντικών και ασθενείς με φαρμακολογικό αναστολέα μιας αποακετυλάσης ιστόνης που τροποποιεί τη χρωματίνη (HDAC) αναγκάζει τα κύτταρα μυελογενούς λευχαιμίας να επαναλάβουν τη διαφοροποίηση σε κύτταρα με πιο ώριμη μορφολογία μυελοειδών κυττάρων. Αυτή η αντίδραση συνοδεύεται από μείωση της πολλαπλασιαστικής ικανότητας, μειώνοντας έτσι την εξέλιξη αυτής της λευχαιμίας (17, 18).
Ένα τρίτο παράδειγμα στο μελάνωμα περιλαμβάνει έναν αναπτυξιακό TF, το SOX10, το οποίο κανονικά ρυθμίζεται προς τα κάτω κατά τη διαφοροποίηση των μελανοκυττάρων. Μελέτες κέρδους και απώλειας λειτουργικότητας σε ένα μοντέλο μελανωμάτων που προκαλούνται από BRAF ψάρια έχουν δείξει ότι η μη φυσιολογικά διατηρούμενη έκφραση του SOX10 εμποδίζει τη διαφοροποίηση των νευρικών προγονικών κυττάρων σε μελανοκύτταρα, επιτρέποντας το σχηματισμό μελανωμάτων που οδηγούνται από BRAF (19).
Άλλα παραδείγματα ρυθμιστών διαφοροποίησης περιλαμβάνουν τον μεταβολίτη άλφα-κετογλουταρικό (αKG), έναν απαραίτητο συμπαράγοντα για έναν αριθμό ενζύμων τροποποίησης της χρωματίνης που έχει αποδειχθεί ότι εμπλέκονται στη διέγερση ορισμένων διαφοροποιημένων κυτταρικών καταστάσεων. Στον καρκίνο του παγκρέατος, ο ογκοκατασταλτικός p53 διεγείρει την παραγωγή αKG και τη διατήρηση μιας πιο διαφοροποιημένης κυτταρικής κατάστασης, ενώ μια πρωτότυπη απώλεια της λειτουργίας της ρ53 οδηγεί σε μείωση των επιπέδων της αKG και επακόλουθη αποδιαφοροποίηση, η οποία σχετίζεται με κακοήθη εξέλιξη (20).
Σε μια μορφή καρκίνου του ήπατος, η μετάλλαξη ενός γονιδίου της ισοκιτρικής αφυδρογονάσης (IDH1/2) δεν έχει ως αποτέλεσμα την παραγωγή αKG που επάγει τη διαφοροποίηση, αλλά μάλλον έναν σχετικό «ογκομεταβολίτη», D-2-υδροξυγλουτερικό (D2HG), που έχει αποδειχθεί ότι εμποδίζει τη διαφοροποίηση ηπατοκυττάρων των κυττάρων αναρρύθμισης του ήπατος-προγονικού D2HG. Ηπατοκυτταρική διαφοροποίηση και ηρεμία, HNF4a.
Η διαμεσολαβούμενη από το D2HG καταστολή της λειτουργίας του HNF4a πυροδοτεί μια πολλαπλασιαστική επέκταση των προγονικών κυττάρων του ήπατος, τα οποία γίνονται επιρρεπή σε ογκογόνο μετασχηματισμό μετά την επακόλουθη μεταλλακτική ενεργοποίηση του ογκογονιδίου KRAS, το οποίο οδηγεί την κακοήθη εξέλιξη σε χολαγγειοκαρκίνωμα (χολαγγειοκαρκίνωμα του χολαγγειοκαρκινώματος). Το μετάλλαγμα IDH1/2 και ο ογκομεταβολίτης του D2HG λειτουργούν επίσης σε μια ποικιλία μυελοειδών και άλλων τύπων συμπαγών όγκων, όπου το D2HG αναστέλλει τις εξαρτώμενες από αKG διοξυγενάσες που απαιτούνται για γεγονότα μεθυλίωσης ιστόνης και DNA που μεσολαβούν σε αλλαγές στη δομή της χρωματίνης κατά τη διάρκεια της διαφοροποίησης της αναπτυξιακής γενεαλογίας, παγώνοντας έτσι την έναρξη των καρκινικών κυττάρων (a22,23)
Μια πρόσθετη, σχετική έννοια είναι η «παρακάμπτουσα διαφοροποίηση», στην οποία μερικώς ή αδιαφοροποίητα προγονικά/βλαστικά κύτταρα εξέρχονται από τον κυτταρικό κύκλο και βρίσκονται σε αδράνεια σε προστατευτικές κόγχες, με δυνατότητα επανέναρξης της πολλαπλασιαστικής επέκτασης ( 24 ), αν και με την επιλεκτική πίεση να διαταραχθεί η προγραμματισμένη διαφοροποίησή τους με τον ένα ή τον άλλο τρόπο.
Μεταδιαφοροποίηση
Η έννοια της διαδιαφοροποίησης έχει αναγνωριστεί από καιρό από τους παθολόγους με τη μορφή μεταπλασίας ιστού, στην οποία κύτταρα ενός συγκεκριμένου διαφοροποιημένου φαινοτύπου αλλάζουν σημαντικά τη μορφολογία τους για να γίνουν ξεκάθαρα αναγνωρίσιμα ως στοιχεία άλλου ιστού, χαρακτηριστικό παράδειγμα του οποίου είναι ο οισοφάγος Barrett, όπου η χρόνια φλεγμονή του στρωματοποιημένου equamous equamous equamous. σε ένα απλό στηλοειδές επιθήλιο χαρακτηριστικό του εντέρου, διευκολύνοντας έτσι την επακόλουθη ανάπτυξη αδενοκαρκινωμάτων αντί των καρκινωμάτων πλακωδών κυττάρων που αναμένονται από αυτό το πλακώδες επιθήλιο (3).
Τώρα, οι μοριακοί καθοριστικοί παράγοντες αποκαλύπτουν μηχανισμούς διαδιαφοροποίησης σε διάφορους καρκίνους, τόσο για περιπτώσεις όπου η αδρή μεταπλασία ιστού είναι εμφανής όσο και για άλλες όπου είναι κάπως πιο λεπτή, όπως δείχνουν τα ακόλουθα παραδείγματα.
Μια πληροφοριακή περίπτωση για τη διαδιαφοροποίηση ως διακριτό συμβάν στην ογκογένεση αφορά το αδενοκαρκίνωμα του παγκρεατικού πόρου (PDAC), στο οποίο ένα από τα εμπλεκόμενα κύτταρα προέλευσης, το κύτταρο του παγκρέατος, μπορεί να διαδιαφοροποιηθεί σε φαινότυπο κυττάρου του πόρου κατά την έναρξη της νεοπλασματικής ανάπτυξης. Δύο TF - PTF1a και MIST1 - ελέγχουν την προδιαγραφή και τη διατήρηση της κατάστασης των διαφοροποιημένων κυψελίδων του παγκρέατος μέσω της έκφρασής τους στο πλαίσιο των αυτοσυντηρούμενων ρυθμιστικών βρόχων "τροφοδοσίας προς τα εμπρός" ( 25 ).
Και οι δύο από αυτούς τους TF συχνά ρυθμίζονται προς τα κάτω κατά τη διάρκεια της νεοπλασματικής ανάπτυξης και της κακοήθους εξέλιξης του PDAC ανθρώπου και ποντικού. Λειτουργικές γενετικές μελέτες σε ποντίκια και καλλιεργημένα ανθρώπινα κύτταρα PDAC έδειξαν ότι η πειραματικά εξαναγκασμένη έκφραση του PTF1a βλάπτει τη μεταδιαφοροποίηση και τον πολλαπλασιασμό που προκαλείται από το KRAS και μπορεί επίσης να αναγκάσει την επαναδιαφοροποίηση ήδη νεοπλασματικών κυττάρων σε φαινότυπο κυττάρου σε ηρεμία (26).
Αντίθετα, η καταστολή της έκφρασης PTF1a πυροδοτεί τη μεταπλασία από κυψελοειδή σε πόρο, δηλαδή τη διαδιαφοροποίηση, και ως εκ τούτου ευαισθητοποιεί τα κύτταρα που μοιάζουν με πόρους στον ογκογόνο μετασχηματισμό KRAS, επιταχύνοντας την επακόλουθη ανάπτυξη διεισδυτικού PDAC (27). Ομοίως, η εξαναγκασμένη έκφραση του MIST1 στο πάγκρεας που εκφράζει KRAS επίσης μπλοκάρει τη διαδιαφοροποίηση και βλάπτει την έναρξη της παγκρεατικής ογκογένεσης, η οποία κατά τα άλλα διευκολύνεται από το σχηματισμό προκακοήθων βλαβών που μοιάζουν με πόρους (PanIN), ενώ η γενετική διαγραφή του MIST1 ενισχύει τον σχηματισμό -2S στην πλαστική όγκωσή τους. ).
Η απώλεια έκφρασης είτε PTF1 είτε MIST1 κατά τη διάρκεια της ογκογένεσης σχετίζεται με αυξημένη έκφραση ενός άλλου αναπτυξιακού ρυθμιστικού TF, του SOX9, το οποίο είναι κανονικά αποτελεσματικό στην προδιαγραφή των κυττάρων του πόρου (27, 28). Η εξαναγκασμένη ανοδική ρύθμιση του SOX9, αποφεύγοντας έτσι την ανάγκη για προς τα κάτω ρύθμιση του PTF1a, και του MIST1, έχει επίσης αποδειχθεί ότι διεγείρει τη διαδιαφοροποίηση των κυψελοειδών κυττάρων σε φαινότυπο κυττάρου του πόρου ευαίσθητο στην επαγόμενη από KRAS νεοπλασία (29), υποδηλώνοντας ότι το SOX9 είναι η βασική λειτουργική τους επίδραση στην ανθρώπινη γονιδιακή ρύθμιση της PD.
Έτσι, τρεις TF που ρυθμίζουν την παγκρεατική διαφοροποίηση μπορούν να τροποποιηθούν με διάφορους τρόπους για να προκαλέσουν μια διαδιαφοροποιημένη κατάσταση που, στο πλαίσιο της μεταλλακτικής ενεργοποίησης του KRAS, διευκολύνει τον ογκογόνο μετασχηματισμό και την έναρξη της ογκογένεσης και της κακοήθους εξέλιξης.
Πρόσθετα μέλη της οικογένειας ρυθμιστικών παραγόντων που σχετίζονται με τη χρωματίνη SOX συνδέονται, αφενός, σε μεγάλο βαθμό τόσο με την προδιαγραφή της μοίρας των κυττάρων όσο και με την αλλαγή γενεαλογίας στην ανάπτυξη (30) και, από την άλλη, με αρκετούς φαινοτύπους που σχετίζονται με όγκους (31). Ένα άλλο χαρακτηριστικό παράδειγμα διαδιαφοροποίησης που προκαλείται από SOX περιλαμβάνει έναν μηχανισμό θεραπευτικής αντίστασης στον καρκίνο του προστάτη.
Σε αυτή την περίπτωση, η απώλεια των ογκοκατασταλτών RB και p53 - η απουσία των οποίων είναι χαρακτηριστική των νευροενδοκρινών όγκων - ως απόκριση στη θεραπεία με αντιανδρογόνα είναι απαραίτητη αλλά όχι επαρκής για τον κοινά παρατηρούμενο μετασχηματισμό καλά διαφοροποιημένων καρκινικών κυττάρων του προστάτη σε καρκινωματικά κύτταρα που έχουν εισβάλει στη γενεαλογία διαφοροποίησης με μοριακά και ιδιαίτερα ιστολογικά χαρακτηριστικά. Εκτός από την απώλεια RB και p53, η επίκτητη αντίσταση στη θεραπεία με αντιανδρογόνα απαιτεί ρυθμισμένη προς τα πάνω έκφραση του SOX2, ενός αναπτυξιακού ρυθμιστικού γονιδίου, το οποίο έχει αποδειχθεί ότι βοηθά στην επαγωγή της διαδιαφοροποίησης των ανταποκρινόμενων στη θεραπεία κυττάρων αδενοκαρκινώματος σε παράγωγα που βρίσκονται σε κατάσταση νευροενδοκρινών κυττάρων ανθεκτικά στη θεραπεία (32).
Ένα τρίτο παράδειγμα δείχνει επίσης τη διαδιαφοροποίηση ως στρατηγική που χρησιμοποιείται από τα καρκινωματικά κύτταρα για την αποφυγή της εξάλειψης με θεραπεία ειδικής γενεαλογίας, σε αυτήν την περίπτωση με βασικοκυτταρικά καρκινώματα (BCCs) του δέρματος που έχουν υποστεί αγωγή με έναν φαρμακολογικό αναστολέα της ογκογονικής οδού Hedgehog-Smoothened (HH/SMO) που είναι γνωστό ότι οδηγεί την ανάπτυξη αυτών των νεοπλαστικών κυττάρων (3).
Τα ανθεκτικά στα φάρμακα καρκινικά κύτταρα μεταπηδούν σε έναν αναπτυξιακά σχετιζόμενο αλλά ξεχωριστό τύπο κυττάρου μέσω ευρειών επιγενετικών αλλαγών σε συγκεκριμένους τομείς χρωματίνης και τροποποιημένης προσβασιμότητας δύο υπερενισχυτών. Η νεοαποκτηθείσα φαινοτυπική κατάσταση των κυττάρων BCC τους επιτρέπει να διατηρούν την έκφραση της ογκογόνου οδού σηματοδότησης WNT, η οποία με τη σειρά της προσδίδει ανεξαρτησία από την κατασταλμένη από το φάρμακο μονοπάτι σηματοδότησης HH/SMO (34).
Όπως αναμενόταν από αυτή τη διαδιαφοροποίηση, το μεταγραφικό των καρκινικών κυττάρων μετατοπίζεται από μια γονιδιακή υπογραφή που αντικατοπτρίζει το εμπλεκόμενο κύτταρο προέλευσης των BCC, δηλαδή τα βλαστικά κύτταρα εξογκώματος τριχοθυλακίου, σε μια υπογραφή ενδεικτική των βασικών βλαστοκυττάρων που κατοικούν τη μεσοθυλακική επιδερμίδα BCC. Αυτή η διαδιαφοροποίηση για να καταστεί δυνατή η ανθεκτικότητα στα φάρμακα τεκμηριώνεται όλο και περισσότερο σε διάφορες μορφές καρκίνου (35).
Η πλαστικότητα της αναπτυξιακής γενεαλογίας φαίνεται επίσης να επικρατεί στους κύριους υποτύπους του καρκινώματος του πνεύμονα, δηλαδή h. σε νευροενδοκρινικά καρκινώματα [μικροκυτταρικός καρκίνος πνεύμονα (SCLC)] και αδενοκαρκινώματα + καρκινώματα πλακωδών κυττάρων [συλλογικός μη μικροκυτταρικός καρκίνος πνεύμονα (NSCLC)]. Η αλληλουχία RNA μονοκυττάρου έχει αποκαλύψει αξιοσημείωτα δυναμική και ετερογενή μετατροπή μεταξύ αυτών των υποτύπων, καθώς και έντονες παραλλαγές τους, κατά τα στάδια της ογκογένεσης του πνεύμονα, της επακόλουθης κακοήθους εξέλιξης και της ανταπόκρισης στη θεραπεία (36-38).
Επομένως, αντί της απλής σύλληψης μιας καθαρής κλωνικής μετάβασης από τη μια γενεαλογία στην άλλη, αυτές οι μελέτες παρουσιάζουν μια πολύ πιο περίπλοκη εικόνα δυναμικά αλληλομετατρεπόμενων υποπληθυσμών καρκινικών κυττάρων που παρουσιάζουν χαρακτηριστικά πολλαπλών αναπτυξιακών γενεαλογιών και σταδίων διαφοροποίησης. Οι ρυθμιστικοί καθοριστικοί παράγοντες αυτής της δυναμικής φαινοτυπικής πλαστικότητας αρχίζουν να εντοπίζονται (37, 39, 40).
Περίληψη
Οι τρεις κατηγορίες μηχανισμών που περιγράφονται παραπάνω υπογραμμίζουν τους επιλεκτικούς ρυθμιστές της κυτταρικής πλαστικότητας που – τουλάχιστον εν μέρει – μπορούν να διαχωριστούν από τους βασικούς ογκογόνους οδηγούς και άλλες διακριτές ικανότητες. Πέρα από αυτά τα παραδείγματα, υπάρχει ένα σημαντικό σύνολο στοιχείων που συνδέουν πολλές μορφές καρκίνου με μειωμένη διαφοροποίηση, η οποία συνοδεύεται από την απόκτηση υπογραφών μεταγραφής και άλλων φαινοτύπων - για παράδειγμα, ιστολογική μορφολογία - που σχετίζονται με στάδια προγονικών ή βλαστοκυττάρων που παρατηρούνται στους αντίστοιχους φυσιολογικούς ιστούς. προέλευσης ή σε άλλους πιο απομακρυσμένους κυτταρικούς τύπους και γενεαλογίες (41 – 43).
Ως εκ τούτου, αυτές οι τρεις υποκατηγορίες φαινοτυπικής πλαστικότητας - αποδιαφοροποίηση ώριμων κυττάρων πίσω σε προγονικές καταστάσεις, καθυστερημένη διαφοροποίηση για πάγωμα αναπτυσσόμενων κυττάρων σε καταστάσεις προγονικών/βλαστικών κυττάρων και διαδιαφοροποίηση σε εναλλακτικές κυτταρικές γενεαλογίες - φαίνεται να είναι αποτελεσματικές σε διάφορους τύπους καρκίνου κατά τη διάρκεια της πρωτοπαθούς ογκογένεσης, της κακοήθους ανταπόκρισης στην ανάπτυξη.
Ωστόσο, υπάρχουν δύο εννοιολογικές εκτιμήσεις. Πρώτον, η αποδιαφοροποίηση και η καθυστερημένη διαφοροποίηση είναι πιθανώς αλληλένδετες, καθώς δεν διακρίνονται σε πολλούς τύπους όγκων στους οποίους το κύτταρο προέλευσης - διαφοροποιημένο κύτταρο ή προγονικό/βλαστικό κύτταρο - είναι είτε άγνωστο είτε εναλλακτικά εμπλέκεται. Δεύτερον, η απόκτηση ή η διατήρηση φαινοτύπων προγονικών κυττάρων και η απώλεια διαφοροποιημένων χαρακτηριστικών είναι, στις περισσότερες περιπτώσεις, μια ανακριβής αντανάκλαση του φυσιολογικού αναπτυξιακού σταδίου, βυθίζοντας σε ένα περιβάλλον άλλων χαρακτηριστικών αλλαγών στο καρκινικό κύτταρο που δεν υπάρχουν σε φυσικά αναπτυσσόμενα κύτταρα.
Επιπλέον, μια άλλη μορφή φαινοτυπικής πλαστικότητας περιλαμβάνει την κυτταρική γήρανση, η οποία συζητείται γενικότερα παρακάτω, όπου τα καρκινικά κύτταρα που προκαλούνται να υποστούν φαινομενικά μη αναστρέψιμη γήρανση μπορούν να διαφύγουν και να συνεχίσουν την πολλαπλασιαστική επέκταση (44). Τέλος, όπως και με άλλες διακριτές ικανότητες, η κυτταρική πλαστικότητα δεν είναι μια νέα εφεύρεση ή παρέκκλιση των καρκινικών κυττάρων, αλλά μάλλον η καταστροφή λανθάνουσας αλλά ενεργοποιήσιμης ικανότητας που χρησιμοποιούν διάφορα φυσιολογικά κύτταρα για να υποστηρίξουν την ομοιόσταση, την επιδιόρθωση και την αναγέννηση (45).
Συνολικά, αυτά τα επεξηγηματικά παραδείγματα ενθαρρύνουν τη σκέψη ότι το ξεκλείδωμα της κυτταρικής πλαστικότητας για να επιτρέψει διάφορες μορφές διαταραγμένης διαφοροποίησης αντιπροσωπεύει μια ξεχωριστή διακριτική ικανότητα που διαφέρει στη ρύθμιση και τον κυτταρικό φαινότυπο από τα καλά επικυρωμένα βασικά χαρακτηριστικά του καρκίνου (Εικ. 2).
Επιγενετικός επαναπρογραμματισμός χωρίς μετάλλαξη
Η ενεργοποιητική ιδιότητα της αστάθειας και της μετάλλαξης του γονιδιώματος (DNA) είναι θεμελιώδες συστατικό της ανάπτυξης και της παθογένεσης του καρκίνου. Επί του παρόντος, αρκετές διεθνείς κοινοπραξίες καταλογίζουν μεταλλάξεις σε όλο το γονιδίωμα των ανθρώπινων καρκινικών κυττάρων, σχεδόν σε κάθε τύπο ανθρώπινου καρκίνου, σε διάφορα στάδια κακοήθους εξέλιξης, συμπεριλαμβανομένων των μεταστατικών βλαβών, και κατά την ανάπτυξη προσαρμοστικής αντίστασης στη θεραπεία. Ένα αποτέλεσμα είναι η ευρέως διαδεδομένη πλέον αναγνώριση ότι μεταλλάξεις σε γονίδια που οργανώνουν, ρυθμίζουν και διατηρούν την αρχιτεκτονική της χρωματίνης και ως εκ τούτου ρυθμίζουν την έκφραση γονιδίων παγκοσμίως ανακαλύπτονται όλο και περισσότερο και συνδέονται λειτουργικά με τα χαρακτηριστικά του καρκίνου (46-48).
Επιπλέον, υπάρχουν επιχειρήματα για μια άλλη φαινομενικά ανεξάρτητη μορφή επαναπρογραμματισμού γονιδιώματος που περιλαμβάνει καθαρά επιγενετικά ρυθμιζόμενες αλλαγές στη γονιδιακή έκφραση, μια που θα μπορούσε να ονομαστεί «μη μεταλλαγμένος επιγενετικός επαναπρογραμματισμός» (Εικ. 3). Στην πραγματικότητα, η θέση της εξέλιξης του καρκίνου χωρίς μεταλλάξεις και του καθαρά επιγενετικού προγραμματισμού χαρακτηριστικών φαινοτύπων καρκίνου τέθηκε σχεδόν πριν από μια δεκαετία (49) και συζητείται όλο και περισσότερο (46, 50-52).
Εικόνα 3

Παρόμοια με ό,τι συμβαίνει κατά τη διάρκεια της εμβρυογένεσης και της διαφοροποίησης των ιστών και της ομοιόστασης, συσσωρευμένα στοιχεία υποδηλώνουν ότι τα οργανικά ρυθμιστικά κυκλώματα γονιδίων και τα δίκτυα στους όγκους μπορούν να ελεγχθούν από μια πληθώρα κατεστραμμένων και επιλεγμένων μηχανισμών που είναι ανεξάρτητοι από την αστάθεια του γονιδιώματος και τη γονιδιακή μετάλλαξη. Τα εμπορικά σήματα του γραφικού καρκίνου υιοθετήθηκαν από τους Hanahan και Weinberg (2).
Φυσικά, η έννοια της μη μεταλλαγμένης επιγενετικής ρύθμισης της γονιδιακής έκφρασης είναι καλά εδραιωμένη ως ο κεντρικός μηχανισμός που μεσολαβεί στην εμβρυϊκή ανάπτυξη, διαφοροποίηση και οργανογένεση (53-55). Στον ενήλικα, για παράδειγμα, η μακροπρόθεσμη μνήμη περιλαμβάνει αλλαγές στην τροποποίηση γονιδίων και ιστόνης, στη δομή της χρωματίνης και στην ενεργοποίηση των διακοπτών έκφρασης γονιδίων, οι οποίοι διατηρούνται σταθερά με την πάροδο του χρόνου από βρόχους θετικής και αρνητικής ανάδρασης (56, 57). Όλο και περισσότερα στοιχεία υποστηρίζουν την ιδέα ότι ανάλογες επιγενετικές αλλαγές μπορεί να συμβάλλουν στην απόκτηση χαρακτηριστικών ικανοτήτων κατά την ανάπτυξη του όγκου και την κακοήθη εξέλιξη. Για να υποστηρίξουμε αυτήν την υπόθεση, παρουσιάζονται μερικά παραδείγματα παρακάτω.
Μικροπεριβαλλοντικοί μηχανισμοί επιγενετικού επαναπρογραμματισμού
Αν όχι μόνο μέσω ογκογόνων μεταλλάξεων, πώς επαναπρογραμματίζεται το γονιδίωμα των καρκινικών κυττάρων; Ένας αυξανόμενος όγκος στοιχείων υποδηλώνει ότι οι ανώμαλες φυσικές ιδιότητες του μικροπεριβάλλοντος του όγκου μπορούν να προκαλέσουν ευρείες αλλαγές στο επιγονιδίωμα, από τις οποίες αλλαγές ευεργετικές για τη φαινοτυπική επιλογή των ικανοτήτων χαρακτηριστικών μπορούν να οδηγήσουν σε κλωνική ανάπτυξη καρκινικών κυττάρων με βελτιωμένη ικανότητα για πολλαπλασιαστική επέκταση.
Ένα κοινό χαρακτηριστικό των όγκων (ή των περιοχών εντός των όγκων) είναι η υποξία ως αποτέλεσμα της ανεπαρκούς αγγείωσης. Η υποξία, για παράδειγμα, μειώνει τη δραστηριότητα των απομεθυλασών ΤΕΤ, οδηγώντας σε σημαντικές αλλαγές στο μεθυλώμα, ιδιαίτερα σε υπερμεθυλίωση ( 58 ). Η ανεπαρκής αγγείωση είναι επίσης πιθανό να περιορίσει τη βιοδιαθεσιμότητα κρίσιμων θρεπτικών συστατικών που μεταδίδονται στο αίμα και η στέρηση θρεπτικών ουσιών, για παράδειγμα, έχει αποδειχθεί ότι μεταβάλλει τον μεταφραστικό έλεγχο και κατά συνέπεια αυξάνει τον κακοήθη φαινότυπο των καρκινικών κυττάρων του μαστού (59).
Ένα συναρπαστικό παράδειγμα επιγενετικής ρύθμισης που προκαλείται από την υποξία είναι μια μορφή του αμετάβλητου θανατηφόρου παιδιατρικού επενδυμώματος. Όπως πολλοί εμβρυϊκοί και παιδιατρικοί όγκοι, αυτή η μορφή στερείται επαναλαμβανόμενων μεταλλάξεων, ιδιαίτερα έλλειψης οδηγικών μεταλλάξεων σε ογκογονίδια και ογκοκατασταλτές. Μάλλον, η ανώμαλη ανάπτυξη αυτών των καρκινικών κυττάρων έχει αποδειχθεί ότι ελέγχεται από ένα γονιδιακό ρυθμιστικό πρόγραμμα που προκαλείται από την υποξία (60, 61). Είναι αξιοσημείωτο ότι το υποτιθέμενο κύτταρο προέλευσης αυτού του καρκίνου βρίσκεται σε ένα υποξικό διαμέρισμα και πιθανότατα ευαισθητοποιεί τα κύτταρα μέσα σε αυτό για να ξεκινήσει η ογκογένεση μέσω άγνωστων ακόμη συμπαραγόντων.
Μια άλλη ακαταμάχητη απόδειξη για την επιγενετική ρύθμιση που διαμεσολαβείται από το μικροπεριβάλλον αφορά την ικανότητα επεμβατικής ανάπτυξης των καρκινικών κυττάρων. Ένα κλασικό παράδειγμα είναι η αναστρέψιμη επαγωγή της διεισδυτικότητας καρκινικών κυττάρων στις άκρες πολλών συμπαγών όγκων, που ενορχηστρώνεται από το αναπτυξιακό ρυθμιστικό πρόγραμμα γνωστό ως μετάβαση από επιθηλιακό σε μεσεγχυματικό (EMT, αναφ. 62-64). Συγκεκριμένα, ένας κύριος ρυθμιστής του EMT, ο ZEB1, αποδείχθηκε πρόσφατα ότι επάγει την έκφραση μιας μεθυλοτρανσφεράσης ιστόνης, SETD1B, η οποία με τη σειρά της διατηρεί την έκφραση ZEB1 σε έναν βρόχο θετικής ανάδρασης που διατηρεί την (επεμβατική) ρυθμιστική κατάσταση της EMT (65).
Μια προηγούμενη μελέτη τεκμηρίωσε ομοίως ότι η επαγωγή του EMT μέσω της προς τα πάνω ρυθμισμένης έκφρασης ενός σχετικού TF, SNAIL1, προκάλεσε σημαντικές αλλαγές στο τοπίο της χρωματίνης ως αποτέλεσμα της επαγωγής ενός αριθμού τροποποιητών χρωματίνης των οποίων η δραστηριότητα αποδείχθηκε απαραίτητη για τη διατήρηση της φαινοτυπικής κατάστασης (66). Επιπλέον, ένας αριθμός καταστάσεων και παραγόντων που αντιμετωπίζουν τα καρκινικά κύτταρα στα άκρα των όγκων, συμπεριλαμβανομένης της υποξίας και των κυτοκινών που εκκρίνονται από τα στρωματικά κύτταρα, μπορούν προφανώς να προκαλέσουν ΕΜΤ και επομένως διεισδυτικότητα (67, 68).
Ένα εντυπωσιακό παράδειγμα προγραμματισμού της επεμβατικότητας από το μικροπεριβάλλον, που υποτίθεται ότι δεν σχετίζεται με το πρόγραμμα EMT, περιλαμβάνει την αυτοκρινή ενεργοποίηση ενός κυκλώματος νευρωνικής σηματοδότησης που περιλαμβάνει εκκρινόμενο γλουταμικό και τον υποδοχέα του NMDAR (69, 70). Είναι αξιοσημείωτο ότι η πρωτότυπη ακαμψία πολλών συμπαγών όγκων, που ενσωματώνεται σε εκτεταμένες αλλοιώσεις στην εξωκυτταρική μήτρα (ECM) που περικλείει τα κύτταρα μέσα τους, έχει βαθιές επιπτώσεις για τις διεισδυτικές και άλλες φαινοτυπικές ιδιότητες των καρκινικών κυττάρων.
Σε σύγκριση με το ECM φυσιολογικού ιστού από το οποίο προέρχονται οι όγκοι, το ECM όγκου χαρακτηρίζεται τυπικά από αυξημένη διασύνδεση και πυκνότητα, ενζυμικές τροποποιήσεις και αλλοιωμένη μοριακή σύνθεση που ενορχηστρώνουν συλλογικά, εν μέρει μέσω υποδοχέων ιντεγκρίνης για μοτίβα ECM, σηματοδότησης επαγόμενης από ακαμψία και άλλα χαρακτηριστικά γονιδιακής έκφρασης σε δίκτυα 71.
Εκτός από τέτοιους ρυθμιστικούς μηχανισμούς που προικίζονται από το φυσικό μικροπεριβάλλον του όγκου, η παρακρινή σηματοδότηση, που περιλαμβάνει διαλυτούς παράγοντες που απελευθερώνονται στο εξωκυτταρικό περιβάλλον από τους διάφορους τύπους κυττάρων που κατοικούν συμπαγείς όγκους, μπορεί επίσης να συμβάλει στην επαγωγή αρκετών μορφολογικά διακριτών προγραμμάτων διεισδυτικής ανάπτυξης ( 72 ), από τα οποία μόνο ένα από τα οποία αναφέρεται παραπάνω. επιγενετικός ρυθμιστικός μηχανισμός της EMT.
Επιγενετική ρυθμιστική ετερογένεια
Μια αυξανόμενη βάση γνώσεων αυξάνει την εκτίμηση για τη σημασία της ενδοογκικής ετερογένειας στη δημιουργία της φαινοτυπικής ποικιλομορφίας όπου τα καταλληλότερα κύτταρα για πολλαπλασιαστική επέκταση και εισβολή ξεπερνούν τα αδέρφια τους και επομένως επιλέγονται για κακοήθη εξέλιξη. Σίγουρα, μια πτυχή αυτής της φαινοτυπικής ετερογένειας οφείλεται στη χρόνια ή επεισοδιακή γονιδιωματική αστάθεια και την προκύπτουσα γενετική ετερογένεια στα κύτταρα που κατοικούν έναν όγκο.
Επιπλέον, γίνεται ολοένα και πιο σαφές ότι μπορεί να υπάρχει επιγενετική ετερογένεια που δεν βασίζεται σε μεταλλάξεις. Ένα χαρακτηριστικό παράδειγμα είναι η συνδετική ιστόνη H1.0, η οποία εκφράζεται δυναμικά και καταστέλλεται σε υποπληθυσμούς καρκινικών κυττάρων εντός μιας σειράς τύπων όγκων, με επακόλουθη δέσμευση ή προσβασιμότητα περιοχών μεγέθους μεγαβάσης [73]. Συγκεκριμένα, ο πληθυσμός των καρκινικών κυττάρων με κατασταλμένο Η1.0 βρέθηκε να παρουσιάζει ιδιότητες που μοιάζουν με στελέχη, ενισχυμένη ικανότητα έναρξης όγκου και συσχέτιση με κακή πρόγνωση σε ασθενείς.
Ένα άλλο παράδειγμα επιγενετικά ρυθμισμένης πλαστικότητας έχει περιγραφεί σε ανθρώπινα στοματικά ακανθοκυτταρικά καρκινώματα (SCC), όπου τα καρκινικά κύτταρα στα διηθητικά όρια υιοθετούν μια μερική κατάσταση EMT (p-EMT) που στερείται των προαναφερθέντων μεσεγχυματικών TFs αλλά εκφράζει άλλα γονίδια που καθορίζουν την EMT που δεν εκφράζονται στον κεντρικό πυρήνα του όγκου (74).
Τα κύτταρα p-EMT προφανώς δεν αντιπροσωπεύουν κλωνική διαμερισματοποίηση μεταλλαγμένων κυττάρων: καλλιέργειες καρκινικών κυττάρων που προέρχονται από πρωτογενή όγκο περιέχουν δυναμικά μείγματα κυττάρων p-EMT hi και p-EMT lo και όταν τα κύτταρα p-EMT hi/lo καθαρίστηκαν και καλλιεργήθηκαν με FACS, και τα δύο επανήλθαν σε μεικτούς πληθυσμούς των p-EMT lo4 ημερών. Αν και τα παρακρινικά σήματα από το γειτονικό στρώμα θα μπορούσαν να θεωρηθούν ντετερμινιστικά για την κατάσταση p-EMT hi, η σταθερή παρουσία και η αναγέννηση των δύο επιγενετικών καταστάσεων στην καλλιέργεια υποστηρίζει έναν εγγενή μηχανισμό καρκινικών κυττάρων. Συγκεκριμένα, αυτό το συμπέρασμα υποστηρίζεται από την ανάλυση 198 κυτταρικών σειρών που αντιπροσωπεύουν 22 τύπους καρκίνου, συμπεριλαμβανομένου του SCC, όπου 12 σταθερά ετερογενείς επιγενετικές καταστάσεις (συμπεριλαμβανομένου του p-EMT στο SCC) ανιχνεύθηκαν ποικιλοτρόπως στα μοντέλα κυτταρικής σειράς καθώς και στους σχετικούς πρωτογενείς όγκους (75).
Και πάλι, οι ετερογενείς φαινοτυπικές καταστάσεις δεν μπόρεσαν να συνδεθούν με ανιχνεύσιμες γενετικές διαφορές και σε αρκετές περιπτώσεις τα κύτταρα μιας συγκεκριμένης κατάστασης ταξινομημένα με FACS έχει αποδειχθεί ότι επανεξισορροπούνται δυναμικά κατά την καλλιέργεια, ανακεφαλαιώνοντας μια σταθερή ισορροπία μεταξύ των ετερογενών καταστάσεων που παρατηρήθηκαν στις αρχικές κυτταρικές σειρές.
Επιπλέον, οι τεχνολογίες για τη δημιουργία προφίλ σε όλο το γονιδίωμα διαφόρων χαρακτηριστικών - πέρα από την αλληλουχία DNA και τη μεταλλαγμένη της παραλλαγή - φωτίζουν σημαντικά στοιχεία του σχολιασμού και της οργάνωσης του γονιδιώματος του καρκινικού κυττάρου που συσχετίζονται με την πρόγνωση του ασθενούς και, όλο και περισσότερο, με τις χαρακτηριστικές ικανότητες (76-78). Η επιγονιδιωματική ετερογένεια αποκαλύπτεται από όλο και πιο ισχυρές τεχνολογίες για τη διαμόρφωση προφίλ μεθυλίωσης DNA σε όλο το γονιδίωμα (79, 80), τροποποίηση ιστόνης (81), προσβασιμότητα χρωματίνης (82) και μετα-μεταγραφική τροποποίηση και μετάφραση του RNA (83, 84).
Μια πρόκληση σε σχέση με το αξίωμα που εξετάζεται εδώ θα είναι να προσδιοριστεί ποιες επιγονιδιωματικές τροποποιήσεις σε ορισμένους τύπους καρκίνου (i) έχουν ρυθμιστική σημασία και (ii) είναι αντιπροσωπευτικές του καθαρά μη μεταλλαγμένου επαναπρογραμματισμού, σε αντίθεση με την αστάθεια που προκαλείται από μετάλλαξη και επομένως εξηγείται από το γονιδίωμα.
Επιγενετική ρύθμιση τύπων στρωματικών κυττάρων που κατοικούν στο μικροπεριβάλλον του όγκου
Γενικά, τα βοηθητικά κύτταρα στο μικροπεριβάλλον του όγκου που λειτουργικά συμβάλλουν στην απόκτηση χαρακτηριστικών ικανοτήτων δεν πιστεύεται ότι πάσχουν από γενετική αστάθεια και επαναπρογραμματισμό μεταλλάξεων για την ενίσχυση των δραστηριοτήτων τους που προωθούν τον όγκο. Αντίθετα, συμπεραίνεται ότι αυτά τα κύτταρα - ινοβλάστες που σχετίζονται με τον καρκίνο, έμφυτα ανοσοκύτταρα και ενδοθηλιακά κύτταρα και περικύτταρα του αγγειακού συστήματος του όγκου - επαναπρογραμματίζονται επιγενετικά κατά την πρόσληψή τους από διαλυτούς και φυσικούς παράγοντες που καθορίζουν το μικροπεριβάλλον του συμπαγούς όγκου (2, 85).
Αναμένεται ότι οι τεχνολογίες πολλαπλών ομικών προφίλ που εφαρμόζονται επί του παρόντος στα καρκινικά κύτταρα θα χρησιμοποιούνται όλο και περισσότερο για τη μελέτη των βοηθητικών (στρωματικών) κυττάρων σε όγκους για να διευκρινιστεί πώς τα φυσιολογικά κύτταρα καταστρέφονται για να υποστηρίξουν λειτουργικά την ανάπτυξη και την εξέλιξη του όγκου. Για παράδειγμα, μια πρόσφατη μελέτη (86) προτείνει ότι ένας τέτοιος επαναπρογραμματισμός μπορεί να περιλαμβάνει τροποποιήσεις του επιγονιδιώματος, επιπλέον της επαγωγικής ανταλλαγής κυτοκινών, χημειοκινών και αυξητικών παραγόντων που μεταβάλλουν τα ενδοκυτταρικά δίκτυα σηματοδότησης σε όλους αυτούς τους τύπους κυττάρων:
Όταν μοντέλα ποντικών με μεταστάσεις στους πνεύμονες υποβλήθηκαν σε θεραπεία με έναν συνδυασμό αναστολέα μεθυλοτρανσφεράσης DNA (5-αζακυτιδίνη) και αναστολέα τροποποίησης ιστόνης (ένα HDAC), τα διεισδυτικά μυελοειδή κύτταρα βρέθηκαν να έχουν μεταβεί από μια ανώριμη (προαγωγική του όγκου) προγονική κατάσταση σε κύτταρα που μοιάζουν με ώριμες διαγωνίες. Σε αντίθεση με τους ομολόγους τους σε όγκους χωρίς θεραπεία, δεν ήταν σε θέση να υποστηρίξουν τις τυπικές ικανότητες που απαιτούνται για αποτελεσματικό μεταστατικό αποικισμό (86). Είναι κατανοητό ότι το πολυ-ομικό προφίλ και οι φαρμακολογικές διαταραχές θα χρησιμεύσουν για την αποσαφήνιση της επαναπρογραμματισμένης επιγενετικής κατάστασης σε τέτοια μυελοειδή κύτταρα καθώς και σε άλλους χαρακτηριστικούς τύπους βοηθητικών κυττάρων που κατοικούν σε μικροπεριβάλλοντα όγκου.
Περίληψη
Συνολικά, αυτά τα επεξηγηματικά στιγμιότυπα υποστηρίζουν τη θέση ότι ο επιγενετικός επαναπρογραμματισμός χωρίς μετάλλαξη θα γίνει αποδεκτός ως ένα αληθινό χαρακτηριστικό που διευκολύνει την απόκτηση χαρακτηριστικών ικανοτήτων (Εικ. 3), διαφορετικές από την αστάθεια και τη μετάλλαξη του γονιδιωματικού DNA. Ειδικότερα, ο μη μεταλλαγμένος επιγενετικός επαναπρογραμματισμός μπορεί να αναμένεται να αποδειχθεί αναπόσπαστο στοιχείο για την ενεργοποίηση της προκαταρκτικής νέας διακριτικής ικανότητας της φαινοτυπικής πλαστικότητας που συζητήθηκε παραπάνω, ιδιαίτερα ως κινητήρια δύναμη στη δυναμική μεταγραφική ετερογένεια που τεκμηριώνεται ολοένα και καλύτερα σε TME κακοήθων καρκινικών κυττάρων. Η πρόοδος των τεχνολογιών πολυ-ωμικής διαμόρφωσης μονοκυττάρων θα ρίξει φως στις αντίστοιχες συνεισφορές και την αλληλεπίδραση μεταξύ της επιγενετικής ρύθμισης που βασίζεται στη μετάλλαξη και της μη μεταλλάξεων στην ανάπτυξη όγκων κατά την κακοήθη εξέλιξη και μετάσταση.
Πολυμορφικά μικροβιώματα
Ένα εκτεταμένο όριο στη βιοϊατρική ξεδιπλώνεται φωτίζοντας την ποικιλομορφία και τη μεταβλητότητα της αφθονίας των μικροοργανισμών, που συλλογικά αναφέρονται ως μικροβίωμα, που συνδέονται συμβιωτικά με τους ιστούς φραγμού του σώματος που εκτίθενται στο εξωτερικό περιβάλλον - ιδιαίτερα την επιδερμίδα και τον εσωτερικό βλεννογόνο του γαστρεντερικού σωλήνα, καθώς και στο γαστρεντερικό σωλήνα, σύστημα.
Γίνεται ολοένα και μεγαλύτερη αναγνώριση ότι τα οικοσυστήματα που δημιουργούνται από βακτήρια και μύκητες -τα μικροβιώματα- έχουν βαθιές επιπτώσεις στην υγεία και τις ασθένειες ( 87 ), γεγονός που καθοδηγείται από την ικανότητα ελέγχου των πληθυσμών των μικροβιακών ειδών χρησιμοποιώντας τεχνολογίες αλληλουχίας επόμενης γενιάς και βιοπληροφορικής. Για τον καρκίνο, τα στοιχεία γίνονται όλο και πιο πειστικά ότι η πολυμορφική μεταβλητότητα στα μικροβιώματα μεταξύ ατόμων σε έναν πληθυσμό μπορεί να έχει βαθιές επιπτώσεις στους φαινοτύπους του καρκίνου (88, 89).
Μελέτες συσχέτισης σε ανθρώπους και πειραματικούς χειρισμούς σε μοντέλα καρκίνου σε ποντίκια αποκαλύπτουν ορισμένους μικροοργανισμούς, κυρίως αλλά όχι αποκλειστικά βακτήρια, που μπορεί να έχουν προστατευτικές ή επιβλαβείς επιδράσεις στην ανάπτυξη καρκίνου, την κακοήθη εξέλιξη και την ανταπόκριση στη θεραπεία. Αυτό ισχύει επίσης για την παγκόσμια πολυπλοκότητα και σύνθεση ενός μικροβιώματος ιστού στο σύνολό του. Ενώ το μικροβίωμα του εντέρου ήταν ο πρωτοπόρος αυτού του νέου συνόρων, αρκετοί ιστοί και όργανα έχουν συσχετίσει μικροβιώματα που παρουσιάζουν διακριτικά χαρακτηριστικά που σχετίζονται με τη δυναμική του πληθυσμού και την ποικιλομορφία των μικροβιακών ειδών και υποειδών.
Αυτή η αυξανόμενη εκτίμηση της σημασίας των πολυμορφικά μεταβλητών μικροβιωμάτων στην υγεία και τις ασθένειες εγείρει το ερώτημα: Είναι το μικροβίωμα ένα ξεχωριστό χαρακτηριστικό που επηρεάζει ευρέως, τόσο θετικά όσο και αρνητικά, την απόκτηση διακριτικών δυνατοτήτων για τον καρκίνο; Εξετάζω αυτήν την πιθανότητα παρακάτω και απεικονίζω στοιχεία για ορισμένα από τα εξέχοντα μικροβιώματα ιστών που εμπλέκονται σε καρκινικά χαρακτηριστικά (Εικ. 4), ξεκινώντας από το πιο προεξέχον και φαινομενικά πιο επιδραστικό μικροβίωμα, αυτό της εντερικής οδού.
Εικόνα 4
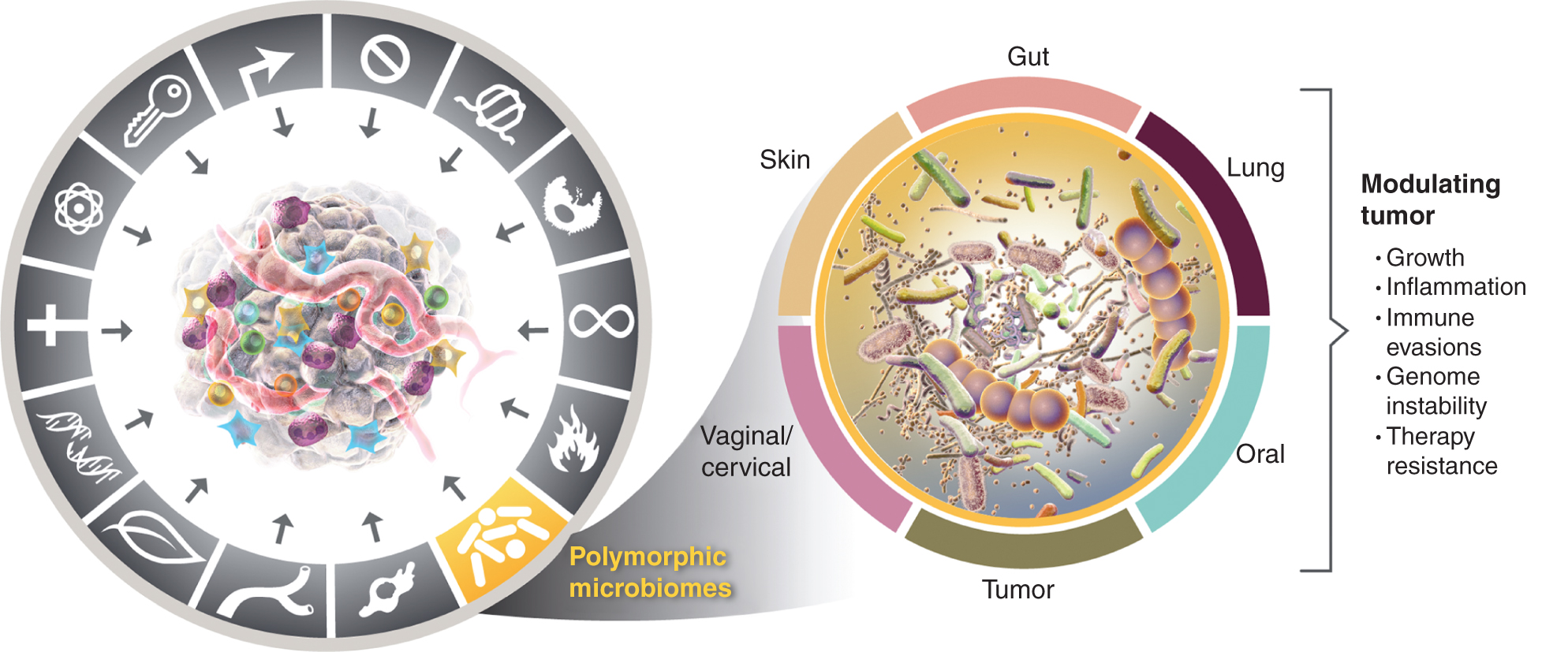
Αριστερά, ενώ οι ευνοϊκές ιδιότητες της φλεγμονής που προάγει τον όγκο και της γονιδιωματικής αστάθειας και μετάλλαξης αλληλεπικαλύπτονται, υπάρχει αυξανόμενος λόγος να συμπεράνουμε ότι τα πολυμορφικά μικροβιώματα που βρίσκονται σε ένα άτομο σε σύγκριση με ένα άλλο στο κόλον, σε άλλους βλεννογόνους και συναφή όργανα ή στους ίδιους τους όγκους, μπορούν να επηρεάσουν πολλές από τις χαρακτηριστικές ικανότητες με διάφορους τρόπους ή με διάφορους τρόπους Η οιονεί ανεξάρτητη μεταβλητή στο παζλ του πώς ο καρκίνος αναπτύσσεται, εξελίσσεται και μεγαλώνει ανταποκρίνεται στη θεραπεία. Είναι αλήθεια ότι πολλαπλά μικροβιώματα ιστών εμπλέκονται στη ρύθμιση των φαινοτύπων του όγκου. Εκτός από το ευρέως μελετημένο μικροβίωμα του εντέρου, άλλα χαρακτηριστικά μικροβίωμα ιστού καθώς και το μικροβίωμα του όγκου εμπλέκονται στη διαμόρφωση της απόκτησης -τόσο θετικών όσο και αρνητικών- των χαρακτηριστικών ικανοτήτων που παρουσιάζονται σε ορισμένους τύπους όγκων. Τα εμπορικά σήματα του γραφικού καρκίνου υιοθετήθηκαν από τους Hanahan και Weinberg (2).
Πολλαπλές ρυθμιστικές επιδράσεις του εντερικού μικροβιώματος
Είναι γνωστό από καιρό ότι το μικροβίωμα του εντέρου είναι θεμελιώδες για τη λειτουργία του παχέος εντέρου (κόλον) στη διάσπαση και εισαγωγή θρεπτικών ουσιών στο σώμα ως μέρος της μεταβολικής ομοιόστασης και ότι η διαταραχή των μικροβιακών πληθυσμών -δυσβίωση- στο κόλον μπορεί να προκαλέσει ένα φάσμα φυσιολογικών ασθενειών (87). Αυτό περιλαμβάνει την υποψία ότι η ευαισθησία, η ανάπτυξη και η παθογένεια του καρκίνου του παχέος εντέρου επηρεάζεται από το εντερικό μικροβίωμα. Τα τελευταία χρόνια, πειστικές λειτουργικές μελέτες που χρησιμοποιούν μοσχεύματα κοπράνων από ασθενείς που φέρουν όγκο στο κόλον και ποντίκια σε ποντίκια λήπτες με προδιάθεση για ανάπτυξη καρκίνου του παχέος εντέρου έχουν θεσπίσει μια αρχή: υπάρχουν τόσο καρκινοπροστατευτικά όσο και καρκινογόνα μικροβιώματα που περιλαμβάνουν συγκεκριμένα βακτηριακά είδη που μπορούν να ρυθμίσουν την εμφάνιση και την παθογένεση όγκων του παχέος εντέρου (90).
Οι μηχανισμοί με τους οποίους η μικροχλωρίδα εκχωρεί αυτούς τους ρυθμιστικούς ρόλους εξακολουθούν να αποσαφηνίζονται, αλλά δύο γενικές επιδράσεις καθιερώνονται όλο και περισσότερο για τα μικροβιώματα που προάγουν τον όγκο και, σε ορισμένες περιπτώσεις, για συγκεκριμένα βακτηριακά είδη που προάγουν τον όγκο. Το πρώτο αποτέλεσμα είναι η μεταλλαξιογένεση του επιθηλίου του παχέος εντέρου ως αποτέλεσμα της παραγωγής βακτηριακών τοξινών και άλλων μορίων που είτε βλάπτουν άμεσα το DNA είτε διαταράσσουν τα συστήματα που διατηρούν τη γονιδιωματική ακεραιότητα ή αλλιώς τονίζουν τα κύτταρα, επηρεάζοντας έμμεσα την πιστότητα της αντιγραφής και επιδιόρθωσης του DNA. Χαρακτηριστικό παράδειγμα είναι το E. coli, το οποίο φέρει τον τόπο PKS, ο οποίος έχει αποδειχθεί ότι μεταλλαξογονεί το ανθρώπινο γονιδίωμα και εμπλέκεται στη μετάδοση μεταλλάξεων που ενεργοποιούν το σημάδι (91).
Επιπλέον, έχει αναφερθεί ότι βακτήρια συνδέονται με την επιφάνεια των επιθηλιακών κυττάρων του παχέος εντέρου και παράγουν μιμητικά συνδέτη που διεγείρουν τον επιθηλιακό πολλαπλασιασμό, συμβάλλοντας στη χαρακτηριστική ικανότητα πολλαπλασιαστικής σηματοδότησης στα νεοπλασματικά κύτταρα (88). Ένας άλλος μηχανισμός με τον οποίο συγκεκριμένοι τύποι βακτηρίων προάγουν την ανάπτυξη όγκου είναι τα βουτυρικά βακτήρια, των οποίων η αφθονία είναι αυξημένη σε ασθενείς με καρκίνο του παχέος εντέρου (92).
Η παραγωγή του βουτυρικού μεταβολίτη έχει πολύπλοκα φυσιολογικά αποτελέσματα, συμπεριλαμβανομένης της επαγωγής γηρασμένων επιθηλιακών και ινοβλαστικών κυττάρων. Ένα μοντέλο ποντικού καρκινογένεσης του παχέος εντέρου αποικισμένο με βακτήρια που παράγουν βουτυρικό ανέπτυξε περισσότερους όγκους από τα ποντίκια που δεν είχαν τέτοια βακτήρια. Η σύνδεση μεταξύ της γήρανσης που προκαλείται από το βουτυρικό και της αυξημένης ογκογένεσης του παχέος εντέρου έχει αποδειχθεί μέσω της χρήσης ενός σενολυτικού φαρμάκου που σκοτώνει τα γηρασμένα κύτταρα, μειώνοντας την ανάπτυξη του όγκου (92).
Επιπλέον, το βουτυρικό που παράγεται από βακτήρια έχει πλειοτροπικές και παράδοξες επιδράσεις σε διαφοροποιημένα κύτταρα σε σύγκριση με αδιαφοροποίητα (βλαστικά) κύτταρα στο επιθήλιο του παχέος εντέρου σε καταστάσεις όπου ο εντερικός φραγμός διαταράσσεται (δυσβίωση) και τα βακτήρια είναι διεισδυτικά, επηρεάζοντας, για παράδειγμα, την κυτταρική ενέργεια και τον μεταβολισμό, την πρόοδο της κυτταρικής προαγωγής. ανοσολογική φλεγμονή που ανοσοκαταστέλλει τις προσαρμοστικές ανοσολογικές αποκρίσεις (93).
Πράγματι, μια ευρεία δράση πολυμορφικών μικροβιωμάτων περιλαμβάνει τη ρύθμιση του προσαρμοστικού και έμφυτου ανοσοποιητικού συστήματος μέσω διαφορετικών οδών, συμπεριλαμβανομένης της παραγωγής «ανοσοτροποποιητικών» παραγόντων από βακτήρια που ενεργοποιούν αισθητήρες βλάβης σε επιθηλιακά ή μόνιμα κύτταρα του ανοσοποιητικού συστήματος, οδηγώντας στην έκφραση ενός διαφορετικού ρεπερτορίου από χημειοκινήσεις που διαμορφώνουν τις ιδιότητες των ανοσοκινών και των κυττάρων. που κατοικούν το επιθήλιο του παχέος εντέρου και το υποκείμενο στρώμα και οι λεμφαδένες παροχέτευσης.
Επιπλέον, ορισμένα βακτήρια μπορούν να παραβιάσουν τόσο το προστατευτικό βιοφίλμ όσο και τη βλέννα που καλύπτουν το επιθήλιο του παχέος εντέρου και να διαταράξουν τις σφιχτές συνδέσεις επιθηλιακών κυττάρων-κυττάρων που διατηρούν συλλογικά την ακεραιότητα του φυσικού φραγμού που κανονικά διαμερισματοποιεί το μικροβίωμα του εντέρου. Κατά την εισβολή στο στρώμα, τα βακτήρια μπορούν να πυροδοτήσουν τόσο έμφυτες όσο και προσαρμοστικές ανοσολογικές αποκρίσεις προκαλώντας την έκκριση ενός ρεπερτορίου κυτοκινών και χημειοκινών. Μια εκδήλωση μπορεί να είναι η δημιουργία ανοσοποιητικών μικροπεριβαλλόντων που προάγουν τον όγκο ή ανταγωνίζονται τον όγκο, τα οποία κατά συνέπεια προστατεύουν ή διευκολύνουν την ογκογένεση και την κακοήθη εξέλιξη.
Αντίστοιχα, η τροποποίηση των αλληλένδετων παραμέτρων (i) της πρόκλησης (έμφυτης) φλεγμονής που προάγει τον όγκο και (ii) της διαφυγής από την (προσαρμοστική) καταστροφή του ανοσοποιητικού συστήματος από χαρακτηριστικά μικροβιώματα σε μεμονωμένους ασθενείς μπορεί να σχετίζεται όχι μόνο με την πρόγνωση αλλά και με την ανταπόκριση ή αντίσταση σε ανοσοθεραπείες με ανοσολογικές θεραπείες και άλλα σημεία ελέγχου ανοσοποιητικά μικροπεριβάλλοντα που προάγουν τον όγκο ή ανταγωνίζονται τον όγκο, τα οποία κατά συνέπεια εμφανίζονται Προστατεύουν ή διευκολύνουν την ανάπτυξη όγκου και την κακοήθη εξέλιξη.
Αντίστοιχα, η τροποποίηση των αλληλένδετων παραμέτρων (i) της πρόκλησης (έμφυτης) φλεγμονής που προάγει τον όγκο και (ii) της διαφυγής από την (προσαρμοστική) καταστροφή του ανοσοποιητικού συστήματος από χαρακτηριστικά μικροβιώματα σε μεμονωμένους ασθενείς μπορεί να σχετίζεται όχι μόνο με την πρόγνωση αλλά και με την ανταπόκριση ή αντίσταση σε ανοσοθεραπείες με ανοσολογικές θεραπείες και άλλα σημεία ελέγχου ανοσοποιητικά μικροπεριβάλλοντα που προάγουν τον όγκο ή ανταγωνίζονται τον όγκο, τα οποία κατά συνέπεια εμφανίζονται προστατεύουν ή διευκολύνουν την ανάπτυξη του όγκου και την κακοήθη εξέλιξη).
Συνεπώς, η τροποποίηση των αλληλένδετων παραμέτρων (i) πρόκλησης (έμφυτης) φλεγμονής που προάγει τον όγκο και (ii) διαφυγής από (προσαρμοστική) ανοσοκαταστροφή από διακριτά μικροβιώματα σε μεμονωμένους ασθενείς μπορεί να σχετίζεται όχι μόνο με την πρόγνωση αλλά και με την απόκριση ή την αντίσταση σε ανοσοθεραπείες με ανοσολογικούς αναστολείς (89,69, αναστολείς του ανοσοποιητικού σημείου ελέγχου). Η προκαταρκτική απόδειξη της ιδέας προέρχεται από πρόσφατες μελέτες που δείχνουν αποκατεστημένη αποτελεσματικότητα της ανοσοθεραπείας μετά από μεταμοσχεύσεις μικροχλωρίδας κοπράνων από ανταποκρινόμενους στη θεραπεία σε ασθενείς με μελάνωμα που είχε προχωρήσει κατά τη διάρκεια προηγούμενης θεραπείας με αποκλεισμό του ανοσοποιητικού σημείου ελέγχου (97, 98).
Οι μοριακοί μηχανισμοί με τους οποίους διακριτά και μεταβλητά συστατικά του μικροβιώματος του εντέρου ρυθμίζουν συστηματικά τη δραστηριότητα του προσαρμοστικού ανοσοποιητικού συστήματος παραμένουν ένα επίμονο μυστήριο, είτε ενισχύοντας τις αντικαρκινικές ανοσολογικές αποκρίσεις που προκαλούνται από αποκλεισμό του ανοσοποιητικού σημείου ελέγχου είτε, μάλλον, προκαλώντας συστηματική ή τοπική (ενδοογκική) ανοσοκαταστολή. Μια πρόσφατη μελέτη έριξε φως: ορισμένα στελέχη Enterococcus (και άλλα βακτήρια) εκφράζουν μια πεπτιδογλυκάνη υδρολυάση που ονομάζεται SagA, η οποία απελευθερώνει βλεννοπεπτίδια από το βακτηριακό τοίχωμα, τα οποία μπορούν στη συνέχεια να κυκλοφορούν συστηματικά και να ενεργοποιήσουν τον υποδοχέα του προτύπου NOD2, ο οποίος με τη σειρά του αυξάνει τις αποκρίσεις των Τ-κυττάρων και την αποτελεσματικότητα της ανοσοθεραπείας σημείου ελέγχου (99).
Άλλα ανοσορυθμιστικά μόρια που παράγονται από συγκεκριμένα βακτηριακά υποείδη ταυτοποιούνται και αξιολογούνται λειτουργικά, συμπεριλαμβανομένης της ινοσίνης που παράγεται από βακτήρια, ενός μεταβολίτη που περιορίζει το ρυθμό για τη δραστηριότητα των Τ κυττάρων (100). Αυτά και άλλα παραδείγματα αρχίζουν να οριοθετούν τους μοριακούς μηχανισμούς με τους οποίους τα πολυμορφικά μικροβιώματα ρυθμίζουν έμμεσα και συστηματικά την ανοσοβιολογία του όγκου, πάνω και πέρα από τις ανοσολογικές αποκρίσεις που ακολουθούν άμεσες φυσικές αλληλεπιδράσεις βακτηρίων με το ανοσοποιητικό σύστημα (101, 102).
Εκτός από τις αιτιολογικές συνδέσεις με τον καρκίνο του παχέος εντέρου και το μελάνωμα, η αποδεδειγμένη ικανότητα του μικροβιώματος του εντέρου να προκαλεί την έκφραση ανοσοτροποποιητικών χημειοκινών και κυτοκινών που εισέρχονται στη συστηματική κυκλοφορία είναι επίσης προφανώς ικανή να επηρεάσει την παθογένεση του καρκίνου και την απόκριση σε θεραπείες σε άλλα όργανα του σώματος (954,).
Ένα διαφωτιστικό παράδειγμα αφορά την ανάπτυξη χολαγγειοκαρκινωμάτων στο ήπαρ: η εντερική δυσβίωση επιτρέπει την είσοδο και τη μεταφορά βακτηρίων και βακτηριακών προϊόντων μέσω της πυλαίας φλέβας στο ήπαρ, όπου ο TLR4 που εκφράζεται στα ηπατοκύτταρα ενεργοποιείται για να επάγει την έκφραση της χημειοκίνης CXCL1, η οποία στρατολογεί τα κύτταρα CXCRnulocy. για την καταστολή των φυσικών φονικών κυττάρων για την αποφυγή της ανοσολογικής καταστροφής (103) και πιθανώς να μεταδώσει άλλες διακριτές ικανότητες (85). Ως εκ τούτου, το μικροβίωμα του εντέρου εμπλέκεται ξεκάθαρα ως ένα χαρακτηριστικό που μπορεί εναλλακτικά να διευκολύνει ή να προστατεύει από πολλαπλούς καρκίνους.
Πέρα από το έντερο: Εμπλοκή διακριτών μικροβιωμάτων σε άλλους ιστούς φραγμού
Σχεδόν όλοι οι ιστοί και τα όργανα που εκτίθενται άμεσα ή έμμεσα στο εξωτερικό περιβάλλον είναι επίσης αποθήκες κοινών μικροοργανισμών ( 104 ). Σε αντίθεση με το έντερο, όπου ο συμβιωτικός ρόλος του μικροβιώματος στο μεταβολισμό είναι καλά αναγνωρισμένος, οι φυσιολογικοί και παθογόνοι ρόλοι της μόνιμης μικροχλωρίδας σε αυτές τις διαφορετικές τοποθεσίες εξακολουθούν να εμφανίζονται.
Υπάρχουν προφανείς διαφορές ειδικές για τα όργανα/ιστούς στη σύσταση των σχετικών μικροβιωμάτων στην ομοιόσταση, τη γήρανση και τον καρκίνο, με επικαλυπτόμενα και διακριτικά είδη και συχνότητες σε σχέση με εκείνα του παχέος εντέρου (104, 105). Επιπλέον, μελέτες συσχέτισης παρέχουν αυξανόμενες ενδείξεις ότι τα τοπικά μικροβιώματα ιστών που ανταγωνίζονται/προστατεύουν έναντι του όγκου, παρόμοια με το μικροβίωμα του εντέρου, μπορούν να ρυθμίσουν την ευαισθησία και την παθογένεση σε ανθρώπινους καρκίνους που εμφανίζονται στα συναφή όργανά τους (106-109).
Επίδραση της ενδοκαρκινικής μικροχλωρίδας;
Τέλος, οι παθολόγοι έχουν από καιρό αναγνωρίσει ότι τα βακτήρια μπορούν να ανιχνευθούν σε συμπαγείς όγκους, μια παρατήρηση που έχει πλέον τεκμηριωθεί από εξελιγμένες τεχνολογίες προφίλ. Για παράδειγμα, σε μια μελέτη 1.526 όγκων που εκτείνονται σε επτά ανθρώπινους τύπους καρκίνου (οστών, εγκεφάλου, μαστού, πνεύμονα, μελάνωμα, ωοθηκών και πάγκρεας), κάθε τύπος χαρακτηρίστηκε από ένα διακριτικό μικροβίωμα, που εντοπίζεται σε μεγάλο βαθμό σε καρκινικά κύτταρα και κύτταρα του ανοσοποιητικού. Σε κάθε τύπο όγκου, παραλλαγές στο μικροβίωμα του όγκου έχουν αποδειχθεί και συμπεράνει ότι σχετίζονται με κλινικοπαθολογικά χαρακτηριστικά (110).
Μικροβίωση έχουν ανιχνευθεί παρομοίως σε de novo γενετικά τροποποιημένα μοντέλα ποντικών καρκίνου του πνεύμονα και του παγκρέατος και η απουσία τους σε ποντίκια χωρίς μικρόβια ή/και η ακύρωσή τους με αντιβιοτικά μπορεί να αποδειχθεί ότι βλάπτει την ογκογένεση, εμπλέκοντας λειτουργικά το μικροβίωμα του όγκου ως πρόδρομο της φλεγμονής που προάγει τον όγκο (11211, φλεγμονή και κακοήθης εξέλιξη).
Μελέτες συσχέτισης στο αδενοκαρκίνωμα ανθρώπινου παγκρεατικού πόρου και λειτουργικές δοκιμασίες μέσω μεταμόσχευσης κοπράνων σε ποντίκια που φέρουν όγκο έχουν δείξει ότι οι παραλλαγές στο μικροβίωμα του όγκου - και στο σχετικό μικροβίωμα του εντέρου - ρυθμίζουν τους φαινοτύπους του ανοσοποιητικού συστήματος και την επιβίωση (113). Μια σημαντική πρόκληση για το μέλλον θα είναι να επεκταθούν αυτές οι επιπτώσεις σε άλλους τύπους όγκων και να διαχωριστούν οι δυνητικά διαχωρισμένες συνεισφορές της σύστασης και της παραλλαγής στο μικροβίωμα του όγκου από αυτές του μικροβιώματος του εντέρου (και του τοπικού ιστού προέλευσης), ίσως με τον εντοπισμό συγκεκριμένων μικροβιακών ειδών που έχουν λειτουργική επιρροή στη μία ή την άλλη θέση.
Περίληψη
Τα ενδιαφέροντα ερωτήματα για το μέλλον περιλαμβάνουν εάν η μικροχλωρίδα που κατοικεί σε διαφορετικούς ιστούς ή εποικίζει αρχόμενα νεοπλάσματα έχει την ικανότητα να συμβάλλει ή να διαταράσσει την απόκτηση άλλων διακριτών δυνατοτήτων πέρα από την ανοσοτροποποίηση και τη γονιδιωματική μετάλλαξη, επηρεάζοντας έτσι την ανάπτυξη και την εξέλιξη του όγκου. Υπάρχουν ενδείξεις ότι ορισμένα βακτηριακά είδη μπορούν να διεγείρουν άμεσα το χαρακτηριστικό της πολλαπλασιαστικής σηματοδότησης, για παράδειγμα στο επιθήλιο του παχέος εντέρου (88) και μπορούν να ρυθμίσουν την καταστολή της ανάπτυξης αλλάζοντας την ογκοκατασταλτική δραστηριότητα σε διαφορετικά διαμερίσματα του εντέρου (114), ενώ άμεσες επιδράσεις σε άλλες χαρακτηριστικές ικανότητες, όπως η αποφυγή κυτταρικής διέγερσης και η τριχογένεια ασαφές, καθώς και η δυνατότητα γενίκευσης αυτών των παρατηρήσεων σε πολλαπλές μορφές ανθρώπινου καρκίνου.
Ανεξάρτητα από αυτό, υπάρχουν ολοένα και πιο επιτακτικά επιχειρήματα ότι η πολυμορφική παραλλαγή στα μικροβιώματα του εντέρου και άλλων οργάνων αντιπροσωπεύει ένα ξεχωριστό χαρακτηριστικό ενεργοποίησης για την απόκτηση διακριτικών δεξιοτήτων (Εικ. 4), ακόμη και αν επικαλύπτεται και συμπληρώνει αυτές της αστάθειας και μετάλλαξης του γονιδιώματος και της φλεγμονής που προάγει τον όγκο.
Γηρασμένα κύτταρα
Η κυτταρική γήρανση είναι μια τυπικά μη αναστρέψιμη μορφή πολλαπλασιαστικής διακοπής που πιθανότατα εξελίχθηκε ως προστατευτικός μηχανισμός για τη διατήρηση της ομοιόστασης των ιστών, φαινομενικά ως συμπληρωματικός μηχανισμός στον προγραμματισμένο κυτταρικό θάνατο που χρησιμεύει για την αδρανοποίηση και, σε εύθετο χρόνο, την απομάκρυνση νοσούντων, δυσλειτουργικών ή άλλως περιττών κυττάρων. Εκτός από το κλείσιμο του κύκλου κυτταρικής διαίρεσης, το πρόγραμμα γήρανσης προκαλεί αλλαγές στη μορφολογία και το μεταβολισμό των κυττάρων και, πιο βαθιά, την ενεργοποίηση ενός εκκριτικού φαινοτύπου που σχετίζεται με τη γήρανση (SASP), ο οποίος περιλαμβάνει την απελευθέρωση μιας πληθώρας βιοδραστικών πρωτεϊνών, συμπεριλαμβανομένων των χημειοκινών.
Κυτοκίνες και πρωτεάσες, η ταυτότητα των οποίων εξαρτάται από τον τύπο κυττάρου και ιστού από τον οποίο προκύπτει ένα γηρασμένο κύτταρο (115-117). Η γήρανση μπορεί να προκληθεί στα κύτταρα από μια ποικιλία συνθηκών, συμπεριλαμβανομένων μικροπεριβαλλοντικών στρες όπως λιμοκτονία και βλάβη DNA, καθώς και βλάβη σε οργανίδια και κυτταρική υποδομή και ανισορροπίες στα δίκτυα κυτταρικής σηματοδότησης ( 115, 117 ), τα οποία έχουν συμβεί στο πλαίσιο της παρατηρούμενης αύξησης στη συχνότητα των γηρασμένων οργάνων (111 σε διάφορα όργανα κατά τη διάρκεια της γήρανσης).
Η κυτταρική γήρανση θεωρείται από καιρό ένας προστατευτικός μηχανισμός έναντι της νεοπλασίας, που προκαλεί τη γήρανση των καρκινικών κυττάρων (120). Οι περισσότεροι από τους προαναφερθέντες εκκινητές του προγράμματος γήρανσης σχετίζονται με κακοήθεια, ειδικά βλάβη του DNA ως αποτέλεσμα ανώμαλου υπερπολλαπλασιασμού, λεγόμενης γήρανσης που προκαλείται από ογκογονίδια λόγω υπερενεργοποιημένης σηματοδότησης και γήρανσης που προκαλείται από θεραπεία ως αποτέλεσμα κυτταρικής και γονιδιωματικής βλάβης που προκαλείται από χημειοθεραπεία και ακτινοθεραπεία.
Πράγματι, υπάρχουν καθιερωμένα παραδείγματα των προστατευτικών οφελών της γήρανσης στον περιορισμό της κακοήθους εξέλιξης (118, 119). Αντίθετα, ωστόσο, ένας αυξανόμενος όγκος στοιχείων δείχνει ακριβώς το αντίθετο: σε ορισμένα πλαίσια, τα γηρασμένα κύτταρα διεγείρουν διαφορικά την ανάπτυξη όγκου και την κακοήθη εξέλιξη (119, 121).
Σε μια οξυδερκή μελέτη περίπτωσης, τα γηρασμένα κύτταρα σε γηρασμένα ποντίκια καταργήθηκαν φαρμακολογικά, εξαντλώντας συγκεκριμένα τα γηρασμένα κύτταρα που εκφράζουν χαρακτηριστικά τον αναστολέα του κυτταρικού κύκλου p16 – INK4a: εκτός από την καθυστέρηση πολλών συμπτωμάτων που σχετίζονται με την ηλικία, αυτό είχε ως αποτέλεσμα την εξάντληση των γηρασμένων κυττάρων σε γηρασμένα ποντίκια με μειωμένη συχνότητα εμφάνισης καρκίνου και καρκίνου. (122).
Ο κύριος μηχανισμός με τον οποίο τα γηρασμένα κύτταρα προάγουν τους φαινοτύπους όγκου πιστεύεται ότι είναι το SASP, το οποίο έχει αποδειχθεί ότι μπορεί να μεσολαβεί σε μόρια σηματοδότησης (και πρωτεάσες που ενεργοποιούν ή/και απενεργοποιούν) με παρακρινό τρόπο για να μεσολαβούν τυπικές ικανότητες. Έτσι, σε διάφορα πειραματικά συστήματα, τα γηρασμένα καρκινικά κύτταρα έχει αποδειχθεί ότι συμβάλλουν με διάφορους τρόπους στην πολλαπλασιαστική σηματοδότηση, αποφεύγουν την απόπτωση, επάγουν αγγειογένεση, διεγείρουν την εισβολή και τη μετάσταση και καταστέλλουν την ανοσία του όγκου (116, 118, 120, 121).
Μια άλλη πτυχή των επιδράσεων των γηρασμένων καρκινικών κυττάρων στους καρκινικούς φαινότυπους περιλαμβάνει παροδικές, αναστρέψιμες γηρασμένες κυτταρικές καταστάσεις, όπου τα γηρασμένα καρκινικά κύτταρα μπορούν να ξεφύγουν από την εκφραστική SASP, μη πολλαπλασιαστική κατάστασή τους και να επαναλάβουν τον κυτταρικό πολλαπλασιασμό και την εκδήλωση των σχετικών δυνατοτήτων ενός πλήρως βιώσιμου ογκογονιδίου κυττάρων (44).
Αυτή η παροδική γήρανση τεκμηριώνεται καλύτερα σε περιπτώσεις αντίστασης στη θεραπεία (44), η οποία αντιπροσωπεύει μια μορφή ηρεμίας που αποφεύγει τη θεραπευτική στόχευση των πολλαπλασιαζόμενων καρκινικών κυττάρων, αλλά μπορεί να αποδειχθεί ευρύτερα αποτελεσματική σε άλλα στάδια ανάπτυξης όγκου, κακοήθους εξέλιξης και μετάστασης.
Επιπλέον, οι ικανότητες προαγωγής σφραγίδας των γηρασμένων κυττάρων δεν περιορίζονται στα γηρασμένα καρκινικά κύτταρα. Οι ινοβλάστες που σχετίζονται με τον καρκίνο (CAF) έχουν αποδειχθεί ότι γερνούν σε όγκους, προκαλώντας γηρασμένα CAF που έχουν αποδειχθεί ότι προάγουν όγκους προσδίδοντας χαρακτηριστικές ικανότητες στα καρκινικά κύτταρα στο TME (115, 116, 121).
Επιπλέον, οι γηρασμένοι ινοβλάστες σε φυσιολογικούς ιστούς, που σχηματίζονται εν μέρει από φυσική γήρανση ή περιβαλλοντικές προσβολές, εμπλέκονται ομοίως στην αναδιαμόρφωση μικροπεριβαλλόντων ιστών μέσω του SASP τους για να παρέχουν παρακρινική υποστήριξη για τοπική εισβολή (τα λεγόμενα «φαινόμενα εφέ») και μακρινή μετάσταση (116) νεοπλασμάτων που αναπτύσσονται κοντά.
Επιπλέον, οι γηρασμένοι ινοβλάστες στο γερασμένο δέρμα έχει αποδειχθεί ότι προσλαμβάνουν -μέσω του SASP τους- έμφυτα ανοσοκύτταρα που είναι αμφότερα ανοσοκατασταλτικά των προσαρμοστικών αντικαρκινικών ανοσολογικών αποκρίσεων που αγκιστρώνονται από CD8 Τ κύτταρα και διεγείρουν την ανάπτυξη όγκου του δέρματος (123), η τελευταία επίδραση πιθανώς αντανακλά τις παρακρινικές συνεισφορές των παρακρινικών ανοσοποιητικών κυττάρων, τέτοιων κυττάρων μακροφάγα) σε άλλες χαρακτηριστικές ικανότητες αντανακλά.
Αν και λιγότερο καλά εδραιωμένο, φαίνεται πιθανό ότι άλλα άφθονα στρωματικά κύτταρα που κατοικούν συγκεκριμένα μικροπεριβάλλοντα όγκου θα υποστούν γήρανση, διαμορφώνοντας έτσι τα χαρακτηριστικά του καρκίνου και τους προκύπτοντες φαινοτύπους όγκου. Για παράδειγμα, τα γηρασμένα ενδοθηλιακά κύτταρα όγκου που προκαλούνται από τη θεραπεία μπορούν να ενισχύσουν τον πολλαπλασιασμό, την εισβολή και τη μετάσταση σε μοντέλα καρκίνου του μαστού (124, 125).
Σίγουρα, τέτοια στοιχεία δικαιολογούν τη διερεύνηση σε άλλους τύπους όγκων για την αξιολόγηση της γενικής γήρανσης των ινοβλαστών, των ενδοθηλιακών κυττάρων και άλλων στρωματικών κυττάρων ως κινητήρια δύναμη στην ανάπτυξη του όγκου. Επίσης επί του παρόντος ασαφείς είναι οι ρυθμιστικοί μηχανισμοί και οι λειτουργικοί καθοριστικοί παράγοντες με τους οποίους ένας συγκεκριμένος γηρασμένος κυτταρικός τύπος σε ένα συγκεκριμένο TME προκαλεί ένα SASP που προάγει τον όγκο έναντι ενός ανταγωνιστή του όγκου SASP, το οποίο προφανώς μπορεί να προκληθεί εναλλακτικά στον ίδιο γηρασμένο κυτταρικό τύπο, ίσως από διαφορετικούς εκκινητές όταν εμβαπτίζεται σε χαρακτηριστικά φυσιολογικά μικροπλαστικά και νεοπλασματικά.
Περίληψη
Η ιδέα ότι οι όγκοι αποτελούνται από γενετικά μετασχηματισμένα καρκινικά κύτταρα που αλληλεπιδρούν και επωφελούνται από στρατολογημένα και επιγενετικά/φαινοτυπικά κατεστραμμένα βοηθητικά (στρωματικά) κύτταρα έχει καθιερωθεί ως ζωτικής σημασίας για την παθογένεση του καρκίνου. Οι εκτιμήσεις που συζητήθηκαν παραπάνω και περιγράφονται στις ανασκοπήσεις και τις αναφορές που αναφέρονται εδώ (και αλλού) υποστηρίζουν πειστικά ότι τα γηρασμένα κύτταρα (ανεξάρτητα από την κυτταρική προέλευση) πρέπει να ληφθούν υπόψη για συμπερίληψη στον κατάλογο των λειτουργικά σημαντικών κυττάρων στο μικροπεριβάλλον του όγκου (Εικ. 5). Ως εκ τούτου, τα γηρασμένα κύτταρα θα πρέπει να λαμβάνονται υπόψη κατά την αναζήτηση εις βάθος γνώσης των μηχανισμών καρκίνου. Επιπλέον, η αναγνώριση της σπουδαιότητάς τους παρακινεί τον δευτερεύοντα στόχο της θεραπευτικής στόχευσης γηρασμένων κυττάρων που προάγουν όγκους όλων των καταστάσεων, είτε μέσω φαρμακολογικής είτε ανοσολογικής κατάλυσης είτε με επαναπρογραμματισμό του SASP σε παραλλαγές που ανταγωνίζονται τον όγκο (115, 121, 126).
Εικόνα 5

Ετερογενείς υποτύποι καρκινικών κυττάρων και τύποι και υποτύποι στρωματικών κυττάρων ενσωματώνονται λειτουργικά στις εκδηλώσεις όγκων ως παράνομα όργανα. Όλο και περισσότερα στοιχεία υποδηλώνουν ότι τα γηρασμένα κυτταρικά παράγωγα πολλών από αυτά τα κυτταρικά συστατικά του TME και τα μεταβλητά SASP τους εμπλέκονται στη διαμόρφωση των δυνατοτήτων χαρακτηριστικών σημάτων και στους προκύπτοντες φαινοτύπους όγκου. Τα εμπορικά σήματα του γραφικού καρκίνου υιοθετήθηκαν από τους Hanahan και Weinberg (2).
Καταληκτικές παρατηρήσεις
Ενώ τα οκτώ χαρακτηριστικά του καρκίνου και τα δύο υποστηρικτικά χαρακτηριστικά τους έχουν αποδειχθεί ότι έχουν διαρκή ευρετική αξία στην εννοιολόγηση του καρκίνου, οι εκτιμήσεις που παρουσιάζονται παραπάνω υποδηλώνουν ότι μπορεί να υπάρχουν νέες πτυχές κάποιας γενικότητας και επομένως σημαντικής για την πληρέστερη κατανόηση των πολυπλοκοτήτων, των μηχανισμών και των εκδηλώσεων της νόσου. Εφαρμόζοντας τη μέτρηση της ευδιάκριτης, αν όχι πλήρους, ανεξαρτησίας από τα 10 βασικά χαρακτηριστικά, μπορεί να υποστηριχθεί ότι αυτές οι τέσσερις παράμετροι -με περαιτέρω επικύρωση και γενίκευση πέρα από τις περιπτωσιολογικές μελέτες που παρουσιάζονται- μπορεί κάλλιστα να ενσωματωθούν στα χαρακτηριστικά του σχήματος του καρκίνου (Εικ. 6).
Ως εκ τούτου, η κυτταρική πλαστικότητα θα μπορούσε να προστεθεί στη λίστα με τις εξέχουσες δυνατότητες. Ενώ ο όγδοος πυρήνας και αυτή η ικανότητα nouveau διακρίνονται εννοιολογικά από τον ορισμό τους ως χαρακτηριστικά, πτυχές της ρύθμισής τους συνδέονται τουλάχιστον εν μέρει σε ορισμένους και ίσως πολλούς καρκίνους. Για παράδειγμα, πολλαπλά χαρακτηριστικά διαμορφώνονται συντονισμένα από κανονικούς ογκογόνους οδηγούς σε ορισμένους τύπους όγκων, συμπεριλαμβανομένων
- (I) KRAS ( https://cancer.sanger.ac.uk/cosmic/census-page/KRAS ),
- (II) MYC ( https://cancer.sanger.ac.uk/cosmic/census-page/MYC ),
- (III) NOTCH ( https://cancer.sanger.ac.uk/cosmic/census-page/NOTCH1 ; Ref. 127) und
- (IV) TP53 ( https://cancer.sanger.ac.uk/cosmic/census-page/TP53 )
Εικόνα 6
Εμφανίζονται οι κανονικές και αναμενόμενες νέες προσθήκες στα «Σήματα του Καρκίνου». Αυτή η εργασία εγείρει την πιθανότητα, με στόχο την τόνωση της συζήτησης, της συζήτησης και της πειραματικής επεξεργασίας, ορισμένες ή και όλες οι τέσσερις νέες παραμέτρους να αναγνωριστούν ως γενικές σε πολλαπλές μορφές ανθρώπινου καρκίνου και επομένως κατάλληλες για ενσωμάτωση στην βασική εννοιολόγηση των χαρακτηριστικών του καρκίνου. Τα εμπορικά σήματα του γραφικού καρκίνου υιοθετήθηκαν από τους Hanahan και Weinberg (2).
Εκτός από την προσθήκη κυτταρικής πλαστικότητας στον κατάλογο, ο μη μεταλλαγμένος επιγενετικός επαναπρογραμματισμός και οι πολυμορφικές παραλλαγές μπορούν να ενσωματωθούν σε μικροβιώματα οργάνων/ιστών ως μηχανιστικοί καθοριστικοί παράγοντες – που επιτρέπουν ιδιότητες – μέσω των οποίων αποκτώνται διακριτικές ικανότητες, μαζί με φλεγμονή που προάγει τον όγκο (από μόνη της εν μέρει αλλοιώσεις που συνδέονται με την ογκογόνοι οδηγοί που αναφέρονται παραπάνω.
Τέλος, γηρασμένα κύτταρα διαφορετικής προέλευσης - συμπεριλαμβανομένων καρκινικών κυττάρων και διαφόρων στρωματικών κυττάρων - που λειτουργικά συμβάλλουν στην ανάπτυξη και κακοήθη εξέλιξη του καρκίνου, αν και με σημαντικά διαφορετικούς τρόπους από αυτά των μη γηρασμένων αδελφών τους, μπορούν να συμπεριληφθούν ως γενικά συστατικά του TME. Συνοπτικά, προβλέπεται ότι η ανάπτυξη αυτών των προκαταρκτικών «πειραματικών μπαλονιών» θα τονώσει τη συζήτηση, τη συζήτηση και την περαιτέρω πειραματική έρευνα στην ερευνητική κοινότητα του καρκίνου σχετικά με τις καθοριστικές εννοιολογικές παραμέτρους της βιολογίας, της γενετικής και της παθογένειας του καρκίνου.
Αναφορές
- Hanahan D , Weinberg RA . The hallmarks of cancer. Cell 2000;100:57–70.
- Hanahan D , Weinberg RA . Hallmarks of cancer: the next generation. Cell 2011;144:646–74.
- Yuan S , Norgard RJ , Stanger BZ . Cellular plasticity in cancer. Cancer Discov 2019;9:837–51.
- Barker N , Ridgway RA , van Es JH , van de Wetering M , Begthel H , van den Born M et al . Crypt stem cells as the cells-of-origin of intestinal cancer. Nature 2009;457:608–11.
- Perekatt AO , Shah PP , Cheung S , Jariwala N , Wu A , Gandhi V et al . SMAD4 suppresses WNT-driven dedifferentiation and oncogenesis in the differentiated gut epithelium. Cancer Res 2018;78:4878–90.
- Shih IM , Wang TL , Traverso G , Romans K , Hamilton SR , Ben-Sasson S et al . Top-down morphogenesis of colorectal tumors. Proc Natl Acad Sci U S A 2001;98:2640–5.
- Ordóñez-Morán P , Dafflon C , Imajo M , Nishida E , Huelsken J . HOXA5 counteracts stem cell traits by inhibiting Wnt signaling in colorectal cancer. Cancer Cell 2015;28:815–29.
- Tan SH , Barker N . Stemming colorectal cancer growth and metastasis: HOXA5 forces cancer stem cells to differentiate. Cancer Cell 2015;28:683–5.
- Köhler C , Nittner D , Rambow F , Radaelli E , Stanchi F , Vandamme N et al . Mouse cutaneous melanoma induced by mutant BRaf arises from expansion and dedifferentiation of mature pigmented melanocytes. Cell Stem Cell 2017;21:679–93.
- Shah M , Bhoumik A , Goel V , Dewing A , Breitwieser W , Kluger H et al . A role for ATF2 in regulating MITF and melanoma development. PLoS Genet 2010;6:e1001258.
- Claps G , Cheli Y , Zhang T , Scortegagna M , Lau E , Kim H et al . A transcriptionally inactive ATF2 variant drives melanomagenesis. Cell Rep 2016;15:1884–92.
- Saghafinia S , Homicsko K , Di Domenico A , Wullschleger S , Perren A , Marinoni I et al . Cancer cells retrace a stepwise differentiation program during malignant progression. Cancer Discov 2021;11:2638–57.
- Yu X-X , Qiu W-L , Yang L , Zhang Y , He M-Y , Li L-C et al . Defining multistep cell fate decision pathways during pancreatic development at single-cell resolution. EMBO J 2019;38:e100164.
- de Thé H . Differentiation therapy revisited. Nat Rev Cancer 2018;18:117–27.
- He LZ , Merghoub T , Pandolfi PP . In vivo analysis of the molecular pathogenesis of acute promyelocytic leukemia in the mouse and its therapeutic implications. Oncogene 1999;18:5278–92.
- Warrell RP , de Thé H , Wang ZY , Degos L . Acute promyelocytic leukemia. N Engl J Med 1993;329:177–89.
- Bots M , Verbrugge I , Martin BP , Salmon JM , Ghisi M , Baker A et al . Differentiation therapy for the treatment of t(8;21) acute myeloid leukemia using histone deacetylase inhibitors. Blood 2014;123:1341–52.
- Ferrara FF , Fazi F , Bianchini A , Padula F , Gelmetti V , Minucci S et al . Histone deacetylase-targeted treatment restores retinoic acid signaling and differentiation in acute myeloid leukemia. Cancer Res 2001;61:2–7.
- Kaufman CK , Mosimann C , Fan ZP , Yang S , Thomas AJ , Ablain J et al . A zebrafish melanoma model reveals emergence of neural crest identity during melanoma initiation. Science 2016;351:aad2197.
- Morris JP , Yashinskie JJ , Koche R , Chandwani R , Tian S , Chen C-C et al . α-Ketoglutarate links p53 to cell fate during tumour suppression. Nature 2019;573:595–9.
- Saha SK , Parachoniak CA , Ghanta KS , Fitamant J , Ross KN , Najem MS et al . Mutant IDH inhibits HNF-4α to block hepatocyte differentiation and promote biliary cancer. Nature 2014;513:110–4.
- Dang L , Su S-SM . Isocitrate dehydrogenase mutation and (R)-2-hydroxyglutarate: from basic discovery to therapeutics development. Annu Rev Biochem 2017;86:305–31.
- Waitkus MS , Diplas BH , Yan H . Biological role and therapeutic potential of IDH mutations in cancer. Cancer Cell 2018;34:186–95.
- Phan TG , Croucher PI . The dormant cancer cell life cycle. Nat Rev Cancer 2020;20:398–411.
- Jiang M , Azevedo-Pouly AC , Deering TG , Hoang CQ , DiRenzo D , Hess DA et al . MIST1 and PTF1 collaborate in feed-forward regulatory loops that maintain the pancreatic acinar phenotype in adult mice. Mol Cell Biol 2016;36:2945–55.
- Krah NM , Narayanan SM , Yugawa DE , Straley JA , Wright CVE , MacDonald RJ et al . Prevention and reversion of pancreatic tumorigenesis through a differentiation-based mechanism. Dev Cell 2019;50:744–54.
- Krah NM , De La O J-P , Swift GH , Hoang CQ , Willet SG , Chen Pan F et al . The acinar differentiation determinant PTF1A inhibits initiation of pancreatic ductal adenocarcinoma. eLife 2015;4:e07125.
- Shi G , DiRenzo D , Qu C , Barney D , Miley D , Konieczny SF . Maintenance of acinar cell organization is critical to preventing Kras-induced acinar-ductal metaplasia. Oncogene 2013;32:1950–8.
- Kopp JL , von Figura G , Mayes E , Liu F-F , Dubois CL , Morris JP et al . Identification of Sox9-dependent acinar-to-ductal reprogramming as the principal mechanism for initiation of pancreatic ductal adenocarcinoma. Cancer Cell 2012;22:737–50.
- Julian LM , McDonald AC , Stanford WL . Direct reprogramming with SOX factors: masters of cell fate. Curr Opin Genet Dev 2017;46:24–36.
- Grimm D , Bauer J , Wise P , Krüger M , Simonsen U , Wehland M et al . The role of SOX family members in solid tumours and metastasis. Semin Cancer Biol 2020;67:122–53.
- Mu P , Zhang Z , Benelli M , Karthaus WR , Hoover E , Chen C-C et al . SOX2 promotes lineage plasticity and antiandrogen resistance in TP53- and RB1-deficient prostate cancer. Science 2017;355:84–8.
- Von Hoff DD , LoRusso PM , Rudin CM , Reddy JC , Yauch RL , Tibes R et al . Inhibition of the hedgehog pathway in advanced basal-cell carcinoma. N Engl J Med 2009;361:1164–72.
- Biehs B , Dijkgraaf GJP , Piskol R , Alicke B , Boumahdi S , Peale F et al . A cell identity switch allows residual BCC to survive Hedgehog pathway inhibition. Nature 2018;562:429–33.
- Boumahdi S , de Sauvage FJ . The great escape: tumour cell plasticity in resistance to targeted therapy. Nat Rev Drug Discov 2020;19:39–56.
- Groves SM , Ireland A , Liu Q , Simmons AJ , Lau K , Iams WT et al . Cancer Hallmarks Define a Continuum of Plastic Cell States between Small Cell Lung Cancer Archetypes [Internet]. Systems Biology; 2021 Jan. Available from: http://biorxiv.org/lookup/doi/10.1101/2021.01.22.427865.
- LaFave LM , Kartha VK , Ma S , Meli K , Del Priore I , Lareau C et al . Epigenomic state transitions characterize tumor progression in mouse lung adenocarcinoma. Cancer Cell 2020;38:212–28.
- Marjanovic ND , Hofree M , Chan JE , Canner D , Wu K , Trakala M et al . Emergence of a high-plasticity cell state during lung cancer evolution. Cancer Cell 2020;38:229–46.
- Drapkin BJ , Minna JD . Studying lineage plasticity one cell at a time. Cancer Cell 2020;38:150–2.
- Inoue Y , Nikolic A , Farnsworth D , Liu A , Ladanyi M , Somwar R et al . Extracellular signal-regulated kinase mediates chromatin rewiring and lineage transformation in lung cancer [Internet]. Cancer Biology; 2020 Nov. Available from: http://biorxiv.org/lookup/doi/10.1101/2020.11.12.368522.
- Dravis C , Chung C-Y , Lytle NK , Herrera-Valdez J , Luna G , Trejo CL et al . Epigenetic and transcriptomic profiling of mammary gland development and tumor models disclose regulators of cell state plasticity. Cancer Cell 2018;34:466–82.
- Malta TM , Sokolov A , Gentles AJ , Burzykowski T , Poisson L , Weinstein JN et al . Machine learning identifies stemness features associated with oncogenic dedifferentiation. Cell 2018;173:338–54.
- Miao Z-F , Lewis MA , Cho CJ , Adkins-Threats M , Park D , Brown JW et al . A dedicated evolutionarily conserved molecular network licenses differentiated cells to return to the cell cycle. Dev Cell 2020;55:178–94.
- De Blander H , Morel A-P , Senaratne AP , Ouzounova M , Puisieux A . Cellular plasticity: a route to senescence exit and tumorigenesis. Cancers 2021;13:4561.
- Merrell AJ , Stanger BZ . Adult cell plasticity in vivo: de-differentiation and transdifferentiation are back in style. Nat Rev Mol Cell Biol 2016;17:413–25.
- Baylin SB , Jones PA . Epigenetic determinants of cancer. Cold Spring Harb Perspect Biol 2016;8:a019505.
- Flavahan WA , Gaskell E , Bernstein BE . Epigenetic plasticity and the hallmarks of cancer. Science 2017;357:eaal2380.
- Jones PA , Issa J-PJ , Baylin S . Targeting the cancer epigenome for therapy. Nat Rev Genet 2016;17:630–41.
- Huang S . Tumor progression: Chance and necessity in Darwinian and Lamarckian somatic (mutationless) evolution. Prog Biophys Mol Biol 2012;110:69–86.
- Darwiche N . Epigenetic mechanisms and the hallmarks of cancer: an intimate affair. Am J Cancer Res 2020;10:1954–78.
- Feng Y , Liu X , Pauklin S . 3D chromatin architecture and epigenetic regulation in cancer stem cells. Protein Cell 2021;12:440–54.
- Nam AS , Chaligne R , Landau DA . Integrating genetic and non-genetic determinants of cancer evolution by single-cell multi-omics. Nat Rev Genet 2021;22:3–18.
- Bitman-Lotan E , Orian A . Nuclear organization and regulation of the differentiated state. Cell Mol Life Sci CMLS 2021;78:3141–58.
- Goldberg AD , Allis CD , Bernstein E . Epigenetics: a landscape takes shape. Cell 2007;128:635–8.
- Zeng Y , Chen T . DNA methylation reprogramming during mammalian development. Genes 2019;10:257.
- Hegde AN , Smith SG . Recent developments in transcriptional and translational regulation underlying long-term synaptic plasticity and memory. Learn Mem 2019;26:307–17.
- Kim S , Kaang B-K . Epigenetic regulation and chromatin remodeling in learning and memory. Exp Mol Med 2017;49:e281.
- Thienpont B , Van Dyck L , Lambrechts D . Tumors smother their epigenome. Mol Cell Oncol 2016;3:e1240549.
- Gameiro PA , Struhl K . Nutrient deprivation elicits a transcriptional and translational inflammatory response coupled to decreased protein synthesis. Cell Rep 2018;24:1415–24.
- Lin GL , Monje M . Understanding the deadly silence of posterior fossa A ependymoma. Mol Cell 2020;78:999–1001.
- Michealraj KA , Kumar SA , Kim LJY , Cavalli FMG , Przelicki D , Wojcik JB et al . Metabolic regulation of the epigenome drives lethal infantile ependymoma. Cell 2020;181:1329–45.
- Bakir B , Chiarella AM , Pitarresi JR , Rustgi AK . EMT, MET, plasticity, and tumor metastasis. Trends Cell Biol 2020;30:764–76.
- Gupta PB , Pastushenko I , Skibinski A , Blanpain C , Kuperwasser C . Phenotypic plasticity: driver of cancer initiation, progression, and therapy resistance. Cell Stem Cell 2019;24:65–78.
- Lambert AW , Weinberg RA . Linking EMT programmes to normal and neoplastic epithelial stem cells. Nat Rev Cancer 2021;21:325–38.
- Lindner P , Paul S , Eckstein M , Hampel C , Muenzner JK , Erlenbach-Wuensch K et al . EMT transcription factor ZEB1 alters the epigenetic landscape of colorectal cancer cells. Cell Death Dis 2020;11:147.
- Javaid S , Zhang J , Anderssen E , Black JC , Wittner BS , Tajima K et al . Dynamic chromatin modification sustains epithelial-mesenchymal transition following inducible expression of Snail-1. Cell Rep 2013;5:1679–89.
- Serrano-Gomez SJ , Maziveyi M , Alahari SK . Regulation of epithelial-mesenchymal transition through epigenetic and post-translational modifications. Mol Cancer 2016;15:18.
- Skrypek N , Goossens S , De Smedt E , Vandamme N , Berx G . Epithelial-to-mesenchymal transition: epigenetic reprogramming driving cellular plasticity. Trends Genet TIG 2017;33:943–59.
- Li L , Hanahan D . Hijacking the neuronal NMDAR signaling circuit to promote tumor growth and invasion. Cell 2013;153:86–100.
- Li L , Zeng Q , Bhutkar A , Galván JA , Karamitopoulou E , Noordermeer D et al . GKAP acts as a genetic modulator of NMDAR signaling to govern invasive tumor growth. Cancer Cell 2018;33:736–51.
- Mohammadi H , Sahai E . Mechanisms and impact of altered tumour mechanics. Nat Cell Biol 2018;20:766–74.
- Odenthal J , Takes R , Friedl P . Plasticity of tumor cell invasion: governance by growth factors and cytokines. Carcinogenesis 2016;37:1117–28.
- Torres CM , Biran A , Burney MJ , Patel H , Henser-Brownhill T , Cohen A-HS et al . The linker histone H1.0 generates epigenetic and functional intratumor heterogeneity. Science 2016;353:aaf1644.
- Puram SV , Tirosh I , Parikh AS , Patel AP , Yizhak K , Gillespie S et al . Single-cell transcriptomic analysis of primary and metastatic tumor ecosystems in head and neck cancer. Cell 2017;171:1611–24.
- Kinker GS , Greenwald AC , Tal R , Orlova Z , Cuoco MS , McFarland JM et al . Pan-cancer single-cell RNA-seq identifies recurring programs of cellular heterogeneity. Nat Genet 2020;52:1208–18.
- Murtha M , Esteller M . Extraordinary cancer epigenomics: thinking outside the classical coding and promoter box. Trends Cancer 2016;2:572–84.
- Nebbioso A , Tambaro FP , Dell’Aversana C , Altucci L . Cancer epigenetics: moving forward. PLoS Genet 2018;14:e1007362.
- Tavernari D , Battistello E , Dheilly E , Petruzzella AS , Mina M , Sordet-Dessimoz J et al . Non-genetic evolution drives lung adenocarcinoma spatial heterogeneity and progression. Cancer Discov 2021;11:1490–507.
- Heyn H , Vidal E , Ferreira HJ , Vizoso M , Sayols S , Gomez A et al . Epigenomic analysis detects aberrant super-enhancer DNA methylation in human cancer. Genome Biol 2016;17:11.
- Saghafinia S , Mina M , Riggi N , Hanahan D , Ciriello G . Pan-cancer landscape of aberrant DNA methylation across human tumors. Cell Rep 2018;25:1066–80.
- Audia JE , Campbell RM . Histone modifications and cancer. Cold Spring Harb Perspect Biol 2016;8:a019521.
- Corces MR , Granja JM , Shams S , Louie BH , Seoane JA , Zhou W et al . The chromatin accessibility landscape of primary human cancers. Science 2018;362:eaav1898.
- Esteve-Puig R , Bueno-Costa A , Esteller M . Writers, readers and erasers of RNA modifications in cancer. Cancer Lett 2020;474:127–37.
- Janin M , Coll-SanMartin L , Esteller M . Disruption of the RNA modifications that target the ribosome translation machinery in human cancer. Mol Cancer 2020;19:70.
- Hanahan D , Coussens LM . Accessories to the crime: functions of cells recruited to the tumor microenvironment. Cancer Cell 2012;21:309–22.
- Lu Z , Zou J , Li S , Topper MJ , Tao Y , Zhang H et al . Epigenetic therapy inhibits metastases by disrupting premetastatic niches. Nature 2020;579:284–90.
- Thomas S , Izard J , Walsh E , Batich K , Chongsathidkiet P , Clarke G et al . The host microbiome regulates and maintains human health: a primer and perspective for non-microbiologists. Cancer Res 2017;77:1783–812.
- Dzutsev A , Badger JH , Perez-Chanona E , Roy S , Salcedo R , Smith CK et al . Microbes and cancer. Annu Rev Immunol 2017;35:199–228.
- Helmink BA , Khan MAW , Hermann A , Gopalakrishnan V , Wargo JA . The microbiome, cancer, and cancer therapy. Nat Med 2019;25:377–88.
- Sears CL , Garrett WS . Microbes, microbiota, and colon cancer. Cell Host Microbe 2014;15:317–28.
- Pleguezuelos-Manzano C , Puschhof J , Rosendahl Huber A , van Hoeck A , Wood HM , Nomburg J et al . Mutational signature in colorectal cancer caused by genotoxic pks+ E. coli. Nature 2020;580:269–73.
- Okumura S , Konishi Y , Narukawa M , Sugiura Y , Yoshimoto S , Arai Y et al . Gut bacteria identified in colorectal cancer patients promote tumourigenesis via butyrate secretion. Nat Commun 2021;12:5674.
- Salvi PS , Cowles RA . Butyrate and the intestinal epithelium: modulation of proliferation and inflammation in homeostasis and disease. Cells 2021;10:1775.
- Fessler J , Matson V , Gajewski TF . Exploring the emerging role of the microbiome in cancer immunotherapy. J Immunother Cancer 2019;7:108.
- Gopalakrishnan V , Helmink BA , Spencer CN , Reuben A , Wargo JA . The influence of the gut microbiome on cancer, immunity, and cancer immunotherapy. Cancer Cell 2018;33:570–80.
- Zitvogel L , Ma Y , Raoult D , Kroemer G , Gajewski TF . The microbiome in cancer immunotherapy: diagnostic tools and therapeutic strategies. Science 2018;359:1366–70.
- Baruch EN , Youngster I , Ben-Betzalel G , Ortenberg R , Lahat A , Katz L et al . Fecal microbiota transplant promotes response in immunotherapy-refractory melanoma patients. Science 2021;371:602–9.
- Davar D , Dzutsev AK , McCulloch JA , Rodrigues RR , Chauvin J-M , Morrison RM et al . Fecal microbiota transplant overcomes resistance to anti–PD-1 therapy in melanoma patients. Science 2021;371:595–602.
- Griffin ME , Espinosa J , Becker JL , Luo J-D , Carroll TS , Jha JK et al . Enterococcus peptidoglycan remodeling promotes checkpoint inhibitor cancer immunotherapy. Science 2021;373:1040–6.
- Mager LF , Burkhard R , Pett N , Cooke NCA , Brown K , Ramay H et al . Microbiome-derived inosine modulates response to checkpoint inhibitor immunotherapy. Science 2020;369:1481–9.
- Ansaldo E , Belkaid Y . How microbiota improve immunotherapy. Science 2021;373:966–7.
- Ansaldo E , Farley TK , Belkaid Y . Control of immunity by the microbiota. Annu Rev Immunol 2021;39:449–79.
- Zhang Q , Ma C , Duan Y , Heinrich B , Rosato U , Diggs LP et al . Gut microbiome directs hepatocytes to recruit MDSCs and promote cholangiocarcinoma. Cancer Discov 2021;11:1248–67.
- Ding T , Schloss PD . Dynamics and associations of microbial community types across the human body. Nature 2014;509:357–60.
- Byrd AL , Liu M , Fujimura KE , Lyalina S , Nagarkar DR , Charbit B et al . Gut microbiome stability and dynamics in healthy donors and patients with non-gastrointestinal cancers. J Exp Med 2021;218:e20200606.
- Healy CM , Moran GP . The microbiome and oral cancer: more questions than answers. Oral Oncol 2019;89:30-3.
- Swaney MH , Kalan LR . Living in your skin: microbes, molecules and mechanisms. Infect Immun 2021;89:e00695–20.
- Willis JR , Gabaldón T . The human oral microbiome in health and disease: from sequences to ecosystems. Microorganisms 2020;8:308.
- Xu J , Peng J-J , Yang W , Fu K , Zhang Y . Vaginal microbiomes and ovarian cancer: a review. Am J Cancer Res 2020;10:743–56.
- Nejman D , Livyatan I , Fuks G , Gavert N , Zwang Y , Geller LT et al . The human tumor microbiome is composed of tumor type-specific intracellular bacteria. Science 2020;368:973–80.
- Jin C , Lagoudas GK , Zhao C , Bullman S , Bhutkar A , Hu B et al . Commensal microbiota promote lung cancer development via γδ T cells. Cell 2019;176:998–1013.
- Pushalkar S , Hundeyin M , Daley D , Zambirinis CP , Kurz E , Mishra A et al . The pancreatic cancer microbiome promotes oncogenesis by induction of innate and adaptive immune suppression. Cancer Discov 2018;8:403–16.
- McAllister F , Khan MAW , Helmink B , Wargo JA . The tumor microbiome in pancreatic cancer: bacteria and beyond. Cancer Cell 2019;36:577–9.
- Kadosh E , Snir-Alkalay I , Venkatachalam A , May S , Lasry A , Elyada E et al . The gut microbiome switches mutant p53 from tumour-suppressive to oncogenic. Nature 2020;586:133–8.
- Birch J , Gil J . Senescence and the SASP: many therapeutic avenues. Genes Dev 2020;34:1565–76.
- Faget DV , Ren Q , Stewart SA . Unmasking senescence: context-dependent effects of SASP in cancer. Nat Rev Cancer 2019;19:439–53.
- Gorgoulis V , Adams PD , Alimonti A , Bennett DC , Bischof O , Bishop C et al . Cellular senescence: defining a path forward. Cell 2019;179:813–27.
- He S , Sharpless NE . Senescence in health and disease. Cell 2017;169:1000–11.
- Kowald A , Passos JF , Kirkwood TBL . On the evolution of cellular senescence. Aging Cell 2020;19:e13270.
- Lee S , Schmitt CA . The dynamic nature of senescence in cancer. Nat Cell Biol 2019;21:94–101.
- Wang B , Kohli J , Demaria M . Senescent cells in cancer therapy: friends or foes? Trends Cancer 2020;6:838–57.
- Baker DJ , Childs BG , Durik M , Wijers ME , Sieben CJ , Zhong J et al . Naturally occurring p16(Ink4a)-positive cells shorten healthy lifespan. Nature 2016;530:184–9.
- Ruhland MK , Loza AJ , Capietto A-H , Luo X , Knolhoff BL , Flanagan KC et al . Stromal senescence establishes an immunosuppressive microenvironment that drives tumorigenesis. Nat Commun 2016;7:11762.
- Hwang HJ , Lee Y-R , Kang D , Lee HC , Seo HR , Ryu J-K et al . Endothelial cells under therapy-induced senescence secrete CXCL11, which increases aggressiveness of breast cancer cells. Cancer Lett 2020;490:100–10.
- Wang D , Xiao F , Feng Z , Li M , Kong L , Huang L et al . Sunitinib facilitates metastatic breast cancer spreading by inducing endothelial cell senescence. Breast Cancer Res 2020;22:103.
- Amor C , Feucht J , Leibold J , Ho Y-J , Zhu C , Alonso-Curbelo D et al . Senolytic CAR T cells reverse senescence-associated pathologies. Nature 2020;583:127–32.
- Aster JC , Pear WS , Blacklow SC . The varied roles of notch in cancer. Annu Rev Pathol 2017;12:245–75.
- Kuczynski EA , Vermeulen PB , Pezzella F , Kerbel RS , Reynolds AR . Vessel co-option in cancer. Nat Rev Clin Oncol 2019;16:469–93.
Google ScholarCrossref

 Suche
Suche
 Mein Konto
Mein Konto
