Vähi tunnused: uued mõõtmed
Eessõna Vähi kontseptualiseerimise tunnused on heuristiline tööriist vähi fenotüüpide ja genotüüpide tohutu keerukuse destilleerimiseks esialgseteks aluspõhimõtete kogumiks. Kuna teadmised vähimehhanismidest on arenenud, on võimalike täiustustena esile kerkinud ka haiguse muud tahud. See suurendab väljavaadet, et fenotüübiline plastilisus ja korrastamata diferentseerumine on selge iseloomulik võime ning et mittemutatsiooniline epigeneetiline ümberprogrammeerimine ja polümorfsed mikrobioomid esindavad nii iseloomulikke võimaldavaid omadusi, mis hõlbustavad iseloomulike võimete omandamist. Lisaks saab kasvaja mikrokeskkonna funktsionaalselt oluliste rakutüüpide loetellu lisada erineva päritoluga vananevaid rakke. See tähendab, et vähk on hirmutav...

Vähi tunnused: uued mõõtmed
Eessõna
Vähi kontseptualiseerimise tunnused on heuristiline tööriist vähi fenotüüpide ja genotüüpide tohutu keerukuse destilleerimiseks esialgseteks aluspõhimõteteks. Kuna teadmised vähimehhanismidest on arenenud, on võimalike täiustustena esile kerkinud ka haiguse muud tahud. See suurendab väljavaadet, et fenotüübiline plastilisus ja korrastamata diferentseerumine on selge iseloomulik võime ning et mittemutatsiooniline epigeneetiline ümberprogrammeerimine ja polümorfsed mikrobioomid esindavad nii iseloomulikke võimaldavaid omadusi, mis hõlbustavad iseloomulike võimete omandamist. Lisaks saab kasvaja mikrokeskkonna funktsionaalselt oluliste rakutüüpide loetellu lisada erineva päritoluga vananevaid rakke.
Tähendus
Vähk on hirmutav oma mitmekesisuse ulatuse ja ulatuse poolest, mis hõlmab geneetikat, raku- ja koebioloogiat, patoloogiat ja ravivastust. Üha võimsamad eksperimentaalsed ja arvutuslikud tööriistad ja tehnoloogiad pakuvad "suurte andmete" laviini lugematute haiguste ilmingute kohta, mida vähk hõlmab. Vähi tunnusjoontes sisalduv integreeriv kontseptsioon aitab selle keerukuse destilleerida üha loogilisemaks teaduseks ning selles perspektiivis esitatud esialgsed uued mõõtmed võivad anda sellele püüdlusele lisaväärtust, et paremini mõista kantserogeneesi ja pahaloomulise progresseerumise mehhanisme ning rakendada neid teadmisi vähimeditsiinis.
sissejuhatus
Vähi tunnuseid on pakutud kui funktsionaalsete võimete kogumit, mille inimrakud omandavad, kui nad liiguvad normaalsest kasvuseisundist neoplastilise kasvu olekusse, täpsemalt võimeid, mis on kriitilise tähtsusega nende võimeks moodustada pahaloomulisi kasvajaid. Nendes artiklites ( 1, 2 ), Bob Weinberg ja mina loetlesime ühised jooned, mis ühendavad kõiki vähirakke raku fenotüübi tasemel. Eesmärk oli luua kontseptuaalne raamistik, mis võimaldaks ratsionaliseerida inimese erinevate kasvajatüüpide ja variantide keerulisi fenotüüpe seoses rakuliste parameetrite ühise komplektiga. Esialgu nägime ette kuue erineva brändivõimaluse täiendava lisamise ja hiljem suurendasime selle arvu kaheksani.
Seda koostist mõjutas äratundmine, et inimese vähid arenevad mitmeastmeliste protsesside saadusena ja et nende funktsionaalsete võimete omandamise võib mingil viisil seostada kasvaja patogeneesi erinevate etappidega. Pahaloomulise patogeneesi mitmekesisus, mis hõlmab mitut kasvajatüüpi ja kasvavat alatüüpide rohkust, hõlmab mitmesuguseid kõrvalekaldeid (ja seega omandatud võimeid ja omadusi), mis on koespetsiifiliste barjääride tulemus, millest teatud tuumorigeneesi radade käigus mööda minnakse. Kuigi me mõistame, et sellised spetsiaalsed mehhanismid võivad olla abiks, oleme piirdunud tunnuste määramisega parameetritega, millel on laialdane mõju inimese vähktõve spektrile.
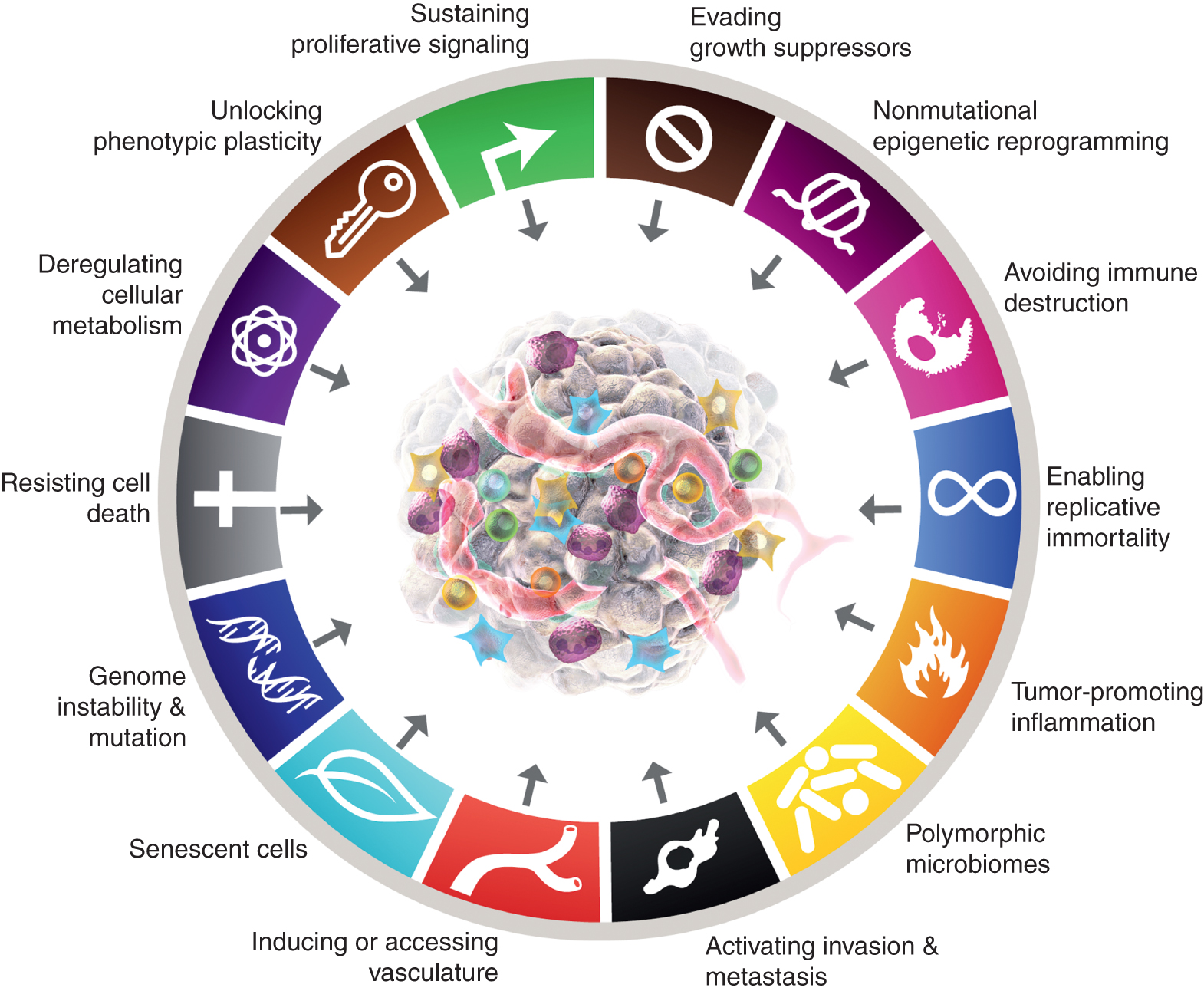
Kaheksa iseloomulikku tunnust hõlmavad praegu (joonis 1, vasakul) omandatud võimeid säilitada proliferatiivset signaaliülekannet, vältida kasvu supressoreid, seista vastu rakusurmale, võimaldada replikatiivset surematust, indutseerida/juurutada veresooni, aktiveerida invasiooni ja metastaase, programmeerida ümber rakkude ainevahetust ja vältida immuunsüsteemi hävimist. Selle kontseptsiooni viimases väljatöötamises (2) piiritleti rakkude metabolismi dereguleerimist ja immuunsüsteemi hävimise vältimist kui "tekkivaid tunnuseid", kuid nüüd, üksteist aastat hiljem, on ilmne, et sarnaselt algse kuuega võib neid pidada vähi peamisteks tunnusteks ja need on sellisena kaasatud praegusesse narratiivi (joonis 1, vasakul).
Joonis 1
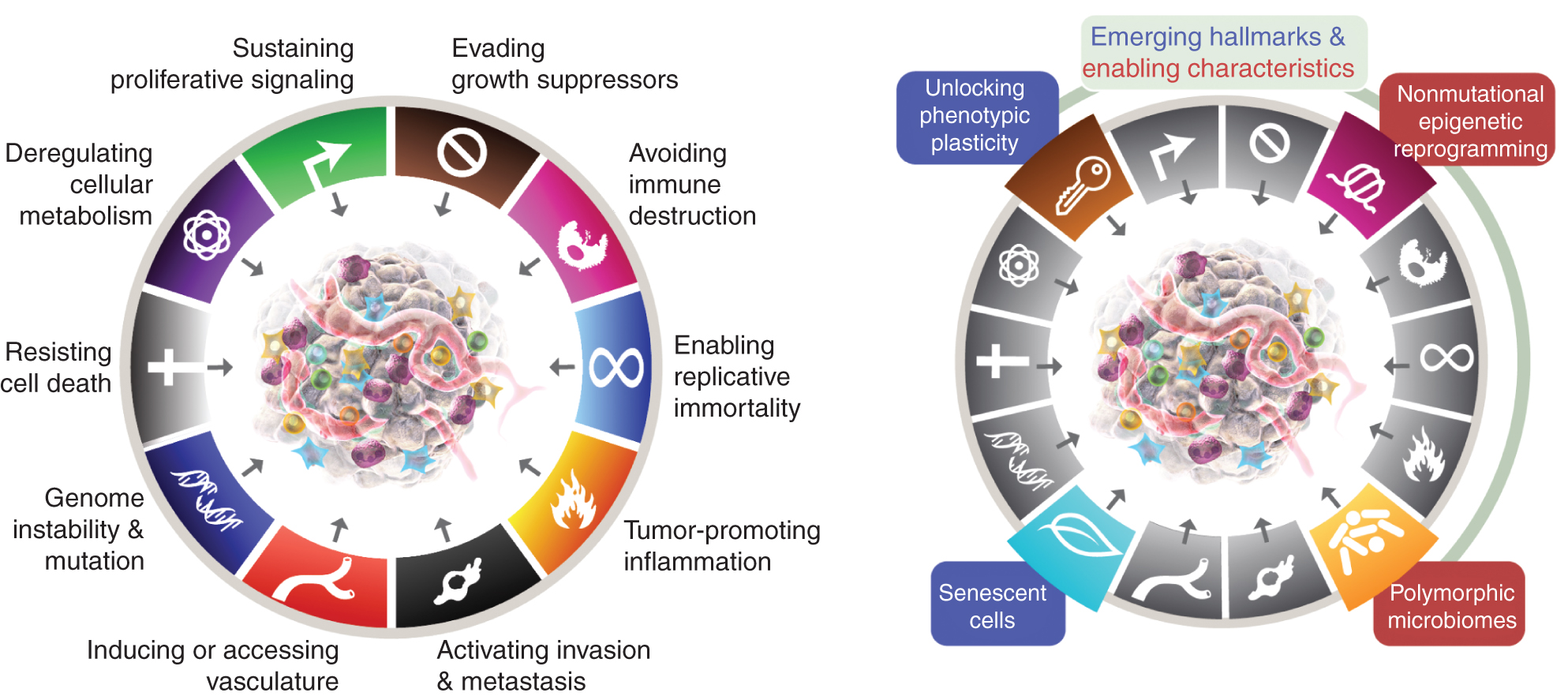
Vähi tunnusjooned kehastavad praegu kaheksat eristavat võimet ja kahte toetavat omadust. Lisaks kuuele omandatud võimele – vähi tunnustele – pakuti välja 2000. aastal (1) – on 2011. aastal kasutusele võetud kaks esialgset “tekitavat tunnust” (2) – rakuline energeetika (praegu sagedamini nimetatud “rakulise ainevahetuse ümberprogrammeerimiseks”) ja “immuunsuse hävimise vältimine” – peetud piisavalt valideerituks, et olla põhiosa.
Arvestades kasvavat arusaama, et kasvajaid saab piisavalt vaskulariseerida, kas angiogeneesi sisselülitamise või normaalse kudede veresoonkonna kaasamise kaudu (128), on see tunnusjoon ka laiemalt määratletud kui võime indutseerida või muul viisil pääseda juurde kasvaja kasvu toetavasse veresoonkonda peamiselt invasiooni ja metastaaside kaudu.
2011. aasta järg hõlmas ka "kasvajat soodustavat põletikku" kui teist võimaldavat tunnust, mis täiendas kõikehõlmavat "genoomi ebastabiilsust ja mutatsiooni", mis koos olid põhiliselt seotud kasvaja kasvuks ja progresseerumiseks vajalike kaheksa signatuuri (funktsionaalse) võime aktiveerimisega. Tõsi, see ülevaade sisaldab täiendavaid kavandatud uusi tunnuseid ja lubavaid funktsioone, sealhulgas "fenotüübilise plastilisuse vabastamine", "mittemutatsiooniline epigeneetiline ümberprogrammeerimine", "polümorfsed mikrobioomid" ja "vananevad rakud". Vähigraafika kaubamärgid võeti üle Hanahanilt ja Weinbergilt (2).
Nagu me omal ajal märkisime, ei suuda need eristavad tunnused üksi käsitleda vähi patogeneesi keerukust, st h. täpsed molekulaarsed ja rakulised mehhanismid, mis võimaldavad arenevatel preneoplastilistel rakkudel areneda ja omandada need ebanormaalsed fenotüübilised võimed kasvaja tekke ja pahaloomulise progresseerumise käigus.
Sellest lähtuvalt oleme lisanud arutelule veel ühe kontseptsiooni, mis on esitatud kui "võimaldavad tunnused", neoplasmi hälbiva seisundi tagajärjed, mis pakuvad vahendeid, mille abil vähirakud ja kasvajad saavad need funktsionaalsed omadused omandada. Sellisena peegelduvad võimaldavad omadused pigem molekulaarsetes ja rakulistes mehhanismides, mille kaudu tunnused omandatakse, mitte ülaltoodud kaheksas oskuses. Need kaks aktiveerimisprotsessi olid genoomi ebastabiilsus ja kasvajat soodustav põletik.
Lisaks tõdesime, et kasvaja mikrokeskkond (TME), mis on siin määratletud kui heterogeensetest ja interaktiivsetest vähirakkude ja vähi tüvirakkude populatsioonidest koos erinevate värvatud stroomarakkude tüüpidega – transformeeritud parenhüüm ja sellega seotud strooma – on nüüd laialdaselt hinnatud, et see mängib olulist rolli tuumorigeneesis ja pahaloomulise kasvaja progresseerumises.
Arvestades jätkuvat huvi nende sõnastuste vastu ja meie jätkuvat kavatsust julgustada pidevat arutelu ja tunnusjoonte skeemi täiustamist, on asjakohane kaaluda korduma kippuvat küsimust: kas selle kontseptuaalse mudeli jaoks on täiendavaid funktsioone, mida võiks lisada, võttes arvesse vajadust seda tagada? et need on laialdaselt kasutatavad kõigis inimese vähivormides? Sellest tulenevalt esitan mitmeid potentsiaalseid uusi tunnuseid ja võimaldavaid funktsioone, mida saaks õigeaegselt integreerida vähi kontseptualiseerimise tunnuste põhikomponentidena.
Need parameetrid on "fenotüübilise plastilisuse vabastamine", "mittemutatsiooniline epigeneetiline ümberprogrammeerimine", "polümorfsed mikrobioomid" ja "vananevad rakud" (joonis 1, paremal). Oluline on see, et nende teeside toetuseks toodud näited on illustreerivad, kuid mitte mingil juhul kõikehõlmavad, kuna iga vinjeti toetuseks on üha rohkem ja üha kaalukamaid avaldatud tõendeid.
Fenotüübilise plastilisuse koputamine
Organogeneesi käigus kaasneb rakkude arenemisega, määramisega ja kudedesse organiseerimisega homöostaatiliste funktsioonide täitmiseks terminaalne diferentseerumine, kusjuures eellasrakud lakkavad kasvamast, mõnikord pöördumatult, kui need protsessid kulmineeruvad. Sellisena on rakkude diferentseerumise lõpptulemus enamikul juhtudel antiproliferatiivne, moodustades selge barjääri neoplaasia jaoks vajaliku jätkuva proliferatsiooni suhtes.
Üha rohkem on tõendeid selle kohta, et fenotüübilise plastilisuse tavapäraselt piiratud võime vabastada terminaalsest diferentseerumisest kõrvalehoidmiseks või sellest pääsemiseks on vähi patogeneesi kriitiline komponent (3). See plastilisus võib toimida mitmel kujul (joonis 2). Seega võivad tekkivad vähirakud, mis pärinevad normaalsest rakust, mis on arenenud mööda teed, mis läheneb täielikult diferentseerunud olekule, või võtavad selle täielikult diferentseerunud olekusse, muutudes tagasi eellasraku olekutesse.
Ja vastupidi, neoplastilised rakud, mis pärinevad eellasrakust, mis on määratud järgima terminaalset diferentseerumiseni viivat rada, võivad protsessi lühistada ja säilitada laienevad vähirakud osaliselt diferentseerunud eellasrakud. Alternatiivina võib toimuda transdiferentseerumine, kus algselt ühele diferentseerumisrajale pühendunud rakud lülituvad üle täiesti erinevale arenguprogrammile ja omandavad seeläbi koespetsiifilised omadused, mida nende normaalsed päritolurakud ei määranud.
Järgmised näited toetavad väidet, et raku plastilisuse erinevad vormid näitavad fenotüübilist plastilisust. Vasakul on fenotüübiline plastilisus vaieldamatult omandatud iseloomulik võime, mis võimaldab rakkude diferentseerumise mitmesuguseid häireid, sealhulgas (i) diferentseerumist küpsest eellasseisundisse, (ii) seiskunud (terminaalset) diferentseerumist eellasrakkude olekutest ja (iii) transdiferentseerumist teistesse rakuliinidesse. Paremal on näidatud kolm silmapaistvat kahjustatud diferentseerumisviisi, mis on vähi patogeneesi lahutamatu osa.
Eellasrakkude normaalse diferentseerumise küpseteks rakkudeks diferentseerumisel arenguliinides hõlbustatakse tuumorigeneesi ja pahaloomulist progresseerumist, mis tuleneb sellistest radadest pärinevatest rakkudest. Vähigraafika kaubamärgid võeti üle Hanahanilt ja Weinbergilt (2).
Joonis 2

Diferentseerumine
Käärsoole kantserogenees on näide halvenenud diferentseerumisest, kuna on olemas teleoloogiline vajadus, et algavad vähirakud pääseksid terminaalse diferentseerumise ja koorimise konveierilindilt, mis võib põhimõtteliselt toimuda käärsoole epiteelirakkude dediferentseerumise kaudu, mis ei ole veel lõplikult diferentseerunud, või erinevate eellas-/krüptitüvirakkude esilekutsuvate eellas-/tüvirakkude diferentseerumise seiskumise kaudu. Nii diferentseerunud rakke kui ka tüvirakke on seostatud käärsoolevähi päritolurakkudena (4–6).
Kaks arengulist transkriptsioonifaktorit (TF), homeoboksi valk HOXA5 ja SMAD4, millest viimane on seotud BMP signaaliülekandega, ekspresseeruvad tugevalt diferentseerivates käärsoole epiteelirakkudes ja on tavaliselt kadunud kaugelearenenud käärsoolekartsinoomides, mis ekspresseerivad iseloomulikult tüvi- ja eellasrakkude markereid. Funktsionaalsed häired hiiremudelites on näidanud, et HOXA5 sunnitud ekspressioon käärsoolevähi rakkudes taastab diferentseerumismarkerid, pärsib tüvirakkude fenotüüpe ning kahjustab invasiooni ja metastaase, andes põhjenduse selle iseloomulikule allareguleerimisele (7, 8).
Seevastu SMAD4 jõustab nii onkogeense WNT signaaliülekande poolt põhjustatud proliferatsiooni diferentseerumise ja pärssimise, mis ilmneb SMAD4 ekspressiooni konstrueeritud kadumise kaudu, pakkudes selgitust selle ekspressiooni kadumisele, mis võimaldab dediferentseerumist ja seejärel WNT-põhist hüperproliferatsiooni (5).
Nimelt on nende kahe "diferentseerumise summutaja" kadumine koos sellest tuleneva dediferentseerumisega seotud teiste tunnuste võimete, aga ka muude tunnuseid esilekutsuvate regulaatorite omandamisega, mis raskendab selle ajutise tunnusmärgi ranget määratlemist eraldatava ja sõltumatuna.
Teine tõendusmaterjal puudutab melanotsüütide diferentseerumise MITF-i pearegulaatori allasurutud ekspressiooni, mis näib olevat seotud pahaloomulise melanoomi agressiivsete vormide tekkega. Selle arengulise TF-i kadumine on seotud närviharja eellasgeenide taasaktiveerimisega ja täielikult diferentseerunud melanotsüüte iseloomustavate geenide allareguleerimisega. Närviharja geenide taasilmumine näitab, et need rakud naasevad eellasseisundisse, millest arenevad melanotsüüdid.
Veelgi enam, BRAF-i indutseeritud melanoomide põlvnemise jälgimise uuring tuvastas küpsed pigmenteerunud melanotsüüdid kui päritolurakud, mis tuumorigeneesi käigus dediferentseeruvad (9). Eelkõige kutsub esile mutantne BRAF-i onkogeen, mida leidub enam kui pooltes naha melanoomides, hüperproliferatsiooni, mis eelneb järgnevale MITF-i alareguleerimisest tulenevale diferentseerumisele ja mida saab seetõttu mehaaniliselt eraldada.
Teine uuring viitas funktsionaalselt areneva TF ATF2 ülesreguleerimisele, mille iseloomulik ekspressioon hiire ja inimese melanoomides pärsib kaudselt MITF1, mis kaasneb sellest tulenevalt dediferentseerunud melanoomirakkude pahaloomulise progresseerumisega (10). Vastupidi, ATF2 mutantsete vormide melanoomides, mis ei suuda MITF-i pärssida, tekib hästi diferentseeritud melanoomid (11).
Lisaks on hiljutises uuringus ( 12 ) seostatud põlvnemise dediferentseerumist pankrease saarerakuliste kasvajate pahaloomulise progresseerumisega metastaasidele kalduvate kartsinoomidega; need neuroendokriinsed rakud ja saadud kasvajad tulenevad arenguliinist, mis erineb sellest, mis tekitab palju suurema arvu naaberrakke, mis moodustavad eksokriinse ja pankrease ning sellest tulenevad duktaalsed adenokartsinoomid.
Tähelepanuväärselt on põhjalikult iseloomustatud mitmeastmelist diferentseerumise rada saarekeste eellasrakkudest küpseteks β-rakkudeks (13). Võrdlev transkriptoomiprofiil näitab, et adenoomitaolised saarekeste kasvajad on kõige sarnasemad ebaküpsete, kuid diferentseerunud insuliini tootvate β-rakkudega, samas kui invasiivsed kartsinoomid on kõige sarnasemad embrüonaalsete saarerakkude prekursoritega. Halvasti diferentseerunud kartsinoomide progresseerumine hõlmab diferentseerumise esialgset etappi, mis algselt ei hõlma suurenenud proliferatsiooni ega vähenenud apoptoosi võrreldes hästi diferentseerunud adenoomidega, mis mõlemad kipuvad ilmnema hiljem.
Seega ei ajenda diferentseerumise diskreetset sammu püsiva proliferatsiooni ja apoptoosi suhtes resistentsuse iseloomulike tunnuste jälgitavad muutused. Pigem on varem saarekeste eellasseisundi täpsustamisega seotud miRNA ülesreguleerimine selline, mis on β-rakkude terminaalse diferentseerumise ajal alla reguleeritud, 12).
Blokeeritud diferentseerimine
Kui ülaltoodud näited illustreerivad, kuidas diferentseerumisfaktori ekspressiooni mahasurumine võib soodustada tuumori teket, võimaldades paremini diferentseerunud rakkudel eellasrakkudeks diferentseeruda, siis muudel juhtudel võivad mittetäielikult diferentseerunud eellasrakud kogeda regulatoorseid muutusi, mis blokeerivad aktiivselt nende edasist progresseerumist täielikult diferentseerunud, tavaliselt mitteproliferatiivsetesse olekutesse.
Pikka aega on dokumenteeritud, et äge promüelotsüütiline leukeemia (APL) tuleneb kromosomaalsest translokatsioonist, mis liidab PML lookuse retinoehappe α tuumaretseptorit (RARα) kodeeriva geeniga. Selliseid translokatsioone kandvad müeloidsed eellasrakud ei suuda ilmselt jätkata oma tavalist terminaalset diferentseerumist granulotsüütideks, mille tulemuseks on rakkude lõksus proliferatiivses, promüelotsüüditaolises eellasstaadiumis (14).
Selle skeemi kontseptsiooni tõestus pärineb kultiveeritud APL-rakkude, haiguse hiiremudelite ja haigete patsientide ravist retinoehappega, RARa ligandiga; See terapeutiline ravi põhjustab neoplastiliste APL-rakkude diferentseerumist näiliselt küpseteks, mitteprolifereeruvateks granulotsüütideks, lühistades seeläbi nende progresseeruva proliferatiivse laienemise (14–16).
Selle teema variatsioon puudutab teist ägeda müeloidse leukeemia vormi, mis kannab t(8;21) translokatsiooni, mis toodab AML1-ETO sulandvalku. See valk üksi võib muuta müeloidseid eellasrakke, vähemalt osaliselt blokeerides nende diferentseerumist. Terapeutiline sekkumine hiiremudelitesse ja patsientidele, kellel on kromatiini modifitseeriva histooni deatsetülaasi (HDAC) farmakoloogiline inhibiitor, põhjustab müeloidse leukeemia rakkude diferentseerumist küpsema müeloidse raku morfoloogiaga rakkudeks. Selle reaktsiooniga kaasneb proliferatsioonivõime vähenemine, mis kahjustab selle leukeemia progresseerumist (17, 18).
Kolmas näide melanoomi puhul hõlmab arengulist TF-i, SOX10, mis on tavaliselt melanotsüütide diferentseerumise ajal alareguleeritud. Funktsiooni suurenemise ja kaotuse uuringud BRAF-indutseeritud melanoomide sebrakala mudelis on näidanud, et SOX10 ebanormaalselt säilinud ekspressioon blokeerib neuraalsete eellasrakkude diferentseerumist melanotsüütideks, võimaldades BRAF-i poolt juhitud melanoomide moodustumist (19).
Teised diferentseerumise modulaatorite näited hõlmavad metaboliiti alfa-ketoglutaraati (αKG), mis on vajalik kofaktor mitmete kromatiini modifitseerivate ensüümide jaoks, mis on näidanud, et nad osalevad teatud diferentseerunud rakuseisundite stimuleerimises. Pankreasevähi korral stimuleerib kasvaja supressor p53 αKG tootmist ja diferentseerituma raku oleku säilitamist, samas kui p53 funktsiooni prototüüpne kadumine viib αKG taseme languseni ja sellest tulenevalt dediferentseerumiseni, mis on seotud pahaloomulise kasvaja progresseerumisega (20).
Ühe maksavähi vormi puhul ei põhjusta isotsitraatdehüdrogenaasi geeni (IDH1/2) mutatsioon diferentseerumist indutseeriva αKG tootmist, vaid pigem sellega seotud "onkometaboliiti", D-2-hüdroksügluteraadi (D2HG), mis on näidanud, et see blokeerib D2H-reguleeritud repressori D2H-ga vahendatud maksa G-eeslasrakkude hepatotsüütide diferentseerumist. diferentseerumine ja vaikus, HNF4a.
D2HG-vahendatud HNF4a funktsiooni pärssimine kutsub esile hepatotsüütide eellasrakkude proliferatiivse laienemise maksas, mis muutuvad vastuvõtlikuks onkogeense transformatsiooni suhtes pärast KRAS onkogeeni järgnevat mutatsioonilist aktiveerimist, mis põhjustab pahaloomulise progresseerumise maksa kolangiokartsinoomiks (21). IDH1/2 mutant ja selle onkometaboliit D2HG toimivad ka mitmesugustes müeloidsetes ja muudes tahkete kasvajate tüüpides, kus D2HG inhibeerib αKG-sõltuvaid dioksügenaase, mis on vajalikud histooni ja DNA metüülimise sündmusteks, mis vahendavad kromatiini struktuuri muutusi arenguliini diferentseerumise käigus, külmutades seeläbi vähirakkude teket (2, 2 eellasrakkudes).
Täiendav, seotud kontseptsioon on „möödajäetud diferentseerumine”, mille puhul osaliselt või diferentseerumata eellasrakud/tüvirakud väljuvad rakutsüklist ja asuvad kaitsvates nišides, mis võivad taaskäivitada proliferatiivset laienemist (24), kuigi neil on endiselt selektiivne surve oma programmeeritud diferentseerumist ühel või teisel viisil häirida.
Transdiferentseerumine
Transdiferentseerumise kontseptsiooni on patoloogid juba pikka aega tunnustanud koe metaplaasia kujul, kus teatud diferentseeritud fenotüübiga rakud muudavad märgatavalt oma morfoloogiat, et muutuda selgelt äratuntavaks teise koe elementidena, mille silmapaistev näide on Barretti söögitoru, kus iseloomuliku kihistunud lameepiteeli krooniline põletik indutseerib lihtsa epiteeli põletikku soolestikku, hõlbustades sellega pigem adenokartsinoomide kui sellest lameepiteeli epiteelist oodatavate lamerakk-kartsinoomide arengut (3).
Nüüd näitavad molekulaarsed determinandid erinevate vähivormide transdiferentseerumise mehhanisme, nii juhtudel, kui kudede jäme metaplaasia on ilmne, kui ka teistel juhtudel, kui see on mõnevõrra peenem, nagu illustreerivad järgmised näited.
Informatiivne juhtum transdiferentseerumise kui tuumorigeneesi diskreetse sündmuse kohta puudutab pankrease duktaalset adenokartsinoomi (PDAC), mille puhul üks kaasatud päritolurakkudest, pankrease atsinaarrakk, võib neoplastilise arengu alguse ajal transdiferentseeruda duktaalseks raku fenotüübiks. Kaks TF-i – PTF1a ja MIST1 – kontrollivad pankrease diferentseeritud atsinaarraku oleku spetsifikatsiooni ja säilitamist nende ekspressiooni kaudu isemajandavate "edasisuunaliste" regulatsioonisilmuste kontekstis (25).
Mõlemad TF-id on sageli alareguleeritud inimese ja hiire PDAC neoplastilise arengu ja pahaloomulise progresseerumise ajal. Funktsionaalsed geneetilised uuringud hiirte ja kultiveeritud inimese PDAC rakkudega on näidanud, et PTF1a eksperimentaalselt sunnitud ekspressioon kahjustab KRAS-i poolt indutseeritud transdiferentseerumist ja proliferatsiooni ning võib samuti sundida juba neoplastiliste rakkude ümberdiferentseerumist vaikseks atsinaarraku fenotüübiks (26).
Seevastu PTF1a ekspressiooni allasurumine vallandab atsinaar-juha metaplaasia, nimelt transdiferentseerumise, ja seeläbi sensibiliseerib kanalitaolisi rakke onkogeense KRAS-i transformatsiooni suhtes, kiirendades järgnevat invasiivse PDAC arengut (27). Samuti blokeerib MIST1 sunnitud ekspressioon KRAS-i ekspresseerivas kõhunäärmes ka transdiferentseerumist ja kahjustab pankrease tuumorigeneesi algust, mida muidu soodustab pahaloomuliste kanalitaoliste (PanIN) kahjustuste moodustumine, samas kui MIST1 geneetiline deletsioon suurendab nende moodustumist ja neoKRAS-i initsiatsiooni (28-i initsiatsioon).
PTF1 või MIST1 ekspressiooni kadumine tuumorigeneesi ajal on seotud teise arengut reguleeriva TF-i SOX9 suurenenud ekspressiooniga, mis on tavaliselt efektiivne duktaalsete rakkude spetsifikatsioonis (27, 28). Samuti on näidatud, et SOX9 sunnitud ülesreguleerimine, vältides vajadust PTF1a ja MIST1 allareguleerimise järele, stimuleerib ka atsinaarrakkude transdiferentseerumist KRAS-i indutseeritud neoplaasia suhtes tundlikuks kanalirakkude fenotüübiks (29), mis tähendab, et SOX9 on nende inimese PDAC-de allareguleerimise peamise funktsionaalse mõjur geenides.
Seega saab kolme pankrease diferentseerumist reguleerivat TF-i mitmel viisil muuta, et kutsuda esile transdiferentseerunud olek, mis KRAS-i mutatsioonilise aktiveerimise kontekstis hõlbustab onkogeenset transformatsiooni ning tuumorigeneesi ja pahaloomulise progresseerumise algatamist.
Täiendavad kromatiiniga seotud regulatoorsete tegurite SOX-perekonna liikmed on ühelt poolt suures osas seotud nii raku saatuse spetsifikatsiooni kui ka liini üleminekuga arengus (30) ja teiselt poolt mitme kasvajaga seotud fenotüübiga (31). Veel üks silmapaistev näide SOX-vahendatud transdiferentseerumisest hõlmab eesnäärmevähi raviresistentsuse mehhanismi.
Sel juhul on RB ja p53 tuumori supressorite kadumine – mille puudumine on iseloomulik neuroendokriinsetele kasvajatele – vastusena antiandrogeeniravile vajalik, kuid mitte piisav selleks, et hästi diferentseerunud eesnäärmevähi rakud muutuksid kartsinoomirakkudeks, mis on tunginud diferentseerumisliini molekulaarsete ja histoloogiliste retseptoritega, mis ei ekspresseeri neuroendokriinsete retseptorite spetsiifilisi omadusi. Lisaks RB ja p53 kadumisele nõuab omandatud resistentsus antiandrogeeniravi suhtes SOX2, arengut reguleeriva geeni ülesreguleeritud ekspressiooni, mis on näidanud, et see aitab indutseerida ravile reageerivate adenokartsinoomirakkude transdiferentseerumist derivaatideks, mis on neuroendokriinse raku seisundis, mis ei allu ravile (32).
Kolmas näide näitab ka transdiferentseerumist kui strateegiat, mida kartsinoomirakud kasutavad, et vältida eliminatsiooni liinispetsiifilise ravi abil, antud juhul naha basaalrakulise kartsinoomi (BCC) puhul, mida on töödeldud siili silutud (HH/SMO) onkogeense raja farmakoloogilise inhibiitoriga, mis teadaolevalt juhib nende rakkude neoplastilist kasvu (33).
Ravimiresistentsed vähirakud lülituvad arenguga seotud, kuid eristatavale rakutüübile spetsiifiliste kromatiini domeenide ulatuslike epigeneetiliste nihete ja kahe supervõimendi muutunud kättesaadavuse kaudu. BCC rakkude äsja omandatud fenotüübiline seisund võimaldab neil säilitada onkogeense WNT signaaliraja ekspressiooni, mis omakorda annab sõltumatuse ravimite allasurutud HH / SMO signaaliülekande rajast (34).
Nagu sellest transdiferentseerumisest eeldati, nihkub vähirakkude transkriptoom geenisignatuurilt, mis peegeldab BCC-de päritolurakku, nimelt juuksefolliikulite kühmu tüvirakke, signatuurile, mis näitab BCC folliikulitevahelist epidermist asustavaid basaalseid tüvirakke. Sellist transdiferentseerumist ravimiresistentsuse võimaldamiseks dokumenteeritakse üha enam erinevate vähivormide puhul (35).
Arenguliini plastilisus näib olevat levinud ka kopsukartsinoomi peamiste alatüüpide puhul, st h. neuroendokriinsete kartsinoomide [väikerakk-kopsuvähk (SCLC)] ja adenokartsinoomide + lamerakk-kartsinoomide [kollektiivne mitteväikerakk-kopsuvähk (NSCLC)] korral. Üherakuline RNA sekveneerimine on paljastanud märkimisväärselt dünaamilise ja heterogeense konversiooni nende alatüüpide vahel, samuti märgatavaid variatsioone selles kopsukasvaja tekke, sellele järgneva pahaloomulise progresseerumise ja ravivastuse staadiumis (36–38).
Seetõttu joonistavad need uuringud puhta klonaalse ülemineku ühest liinist teise lihtsa kontseptualiseerimise asemel palju keerulisema pildi vähirakkude dünaamiliselt vastastikku muunduvatest alampopulatsioonidest, millel on mitme arenguliini ja diferentseerumisfaasi tunnused, mis on kainestav ülevaade inimese kopsuvähi liinipõhisest terapeutilisest sihtimisest. Selle dünaamilise fenotüübilise plastilisuse reguleerivaid determinante hakatakse tuvastama (37, 39, 40).
Kokkuvõte
Eespool kirjeldatud kolm mehhanismide klassi tõstavad esile rakulise plastilisuse selektiivsed regulaatorid, mis on vähemalt osaliselt eraldatavad põhilistest onkogeensetest draiveritest ja muudest eristatavatest võimalustest. Lisaks nendele näidetele on olemas märkimisväärne hulk tõendeid, mis seovad paljusid vähivorme diferentseerumise halvenemisega, millega kaasneb transkriptoomiliste signatuuride ja muude fenotüüpide – näiteks histoloogilise morfoloogia – omandamine, mis on seotud vastavates normaalsetes kudedes täheldatud eellas- või tüvirakkude staadiumidega. päritolu või muudes kaugemal seotud rakutüüpides ja -liinides (41–43).
Sellisena näivad need fenotüübilise plastilisuse kolm alamklassi – küpsete rakkude dediferentseerumine tagasi eellasseisunditesse, seiskunud diferentseerumine arenevate rakkude külmutamiseks eellas-/tüvirakkude olekutes ja transdiferentseerumine alternatiivseteks rakuliinideks – tõhusad mitmete vähitüüpide puhul esmase tuumorigeneesi, pahaloomulise ravivastuse ja/või ravi ajal.
Siiski on kaks kontseptuaalset kaalutlust. Esiteks on dediferentseerumine ja seiskunud diferentseerumine tõenäoliselt läbi põimunud, kuna neid ei saa eristada paljudes kasvajatüüpides, mille päritolurakk - diferentseeritud rakk või eellasrakk / tüvirakk - on kas teadmata või alternatiivselt kaasatud. Teiseks on eellasrakkude fenotüüpide omandamine või säilitamine ja diferentseeritud tunnuste kadumine enamikul juhtudel normaalse arenguetapi ebatäpne peegeldus, mis sukeldub vähiraku muude iseloomulike muutuste miljöösse, mida looduslikult arenevates rakkudes ei esine.
Lisaks hõlmab fenotüübilise plastilisuse teine vorm rakkude vananemist, mida käsitletakse üldisemalt allpool, mille käigus vähirakud, mis on esile kutsutud näiliselt pöördumatuks vananemiseks, on võimelised põgenema ja jätkama proliferatiivset laienemist (44). Lõpuks, nagu ka teiste eristavate võimete puhul, ei ole rakuline plastilisus vähirakkude uus leiutis ega aberratsioon, vaid pigem varjatud, kuid aktiveeritavate võimete rikkumine, mida erinevad normaalsed rakud kasutavad homöostaasi, parandamise ja regeneratsiooni toetamiseks (45).
Üldiselt julgustavad need illustreerivad näited kaaluma, et raku plastilisuse vabastamine, et võimaldada erinevaid häiritud diferentseerumise vorme, kujutab endast selget eristavat võimet, mis erineb regulatsiooni ja raku fenotüübi poolest vähi hästi kinnitatud põhitunnustest (joonis 2).
Epigeneetiline ümberprogrammeerimine ilma mutatsioonita
Genoomi (DNA) ebastabiilsuse ja mutatsiooni võimaldav omadus on vähi arengu ja patogeneesi põhikomponent. Praegu kataloogivad mitmed rahvusvahelised konsortsiumid mutatsioone kogu inimese vähirakkude genoomis, peaaegu igat tüüpi inimese vähis, pahaloomulise progresseerumise erinevates etappides, sealhulgas metastaatilised kahjustused, ja adaptiivse ravi resistentsuse kujunemise ajal. Üks tulemus on nüüdseks laialt levinud tõdemus, et mutatsioone geenides, mis organiseerivad, moduleerivad ja säilitavad kromatiini arhitektuuri ning seeläbi reguleerivad geeniekspressiooni globaalselt, avastatakse üha enam ja seostatakse neid funktsionaalselt vähi tunnustega (46–48).
Lisaks on argumendid veel ühe näiliselt sõltumatu genoomi ümberprogrammeerimise vormi poolt, mis hõlmab puhtalt epigeneetiliselt reguleeritud muutusi geeniekspressioonis, mida võiks nimetada "mittemutatsiooniliseks epigeneetiliseks ümberprogrammeerimiseks" (joonis 3). Tegelikult tõstatati mutatsioonideta vähi evolutsiooni ja iseloomulike vähifenotüüpide puhtalt epigeneetilise programmeerimise tees peaaegu kümme aastat tagasi (49) ja seda arutatakse üha enam (46, 50–52).
Joonis 3

Sarnaselt embrüogeneesi ja kudede diferentseerumise ja homöostaasi ajal toimuvale viitavad kogunevad tõendid sellele, et kasvajate instrumentaalseid geeniregulatsiooni ahelaid ja võrke saab kontrollida paljude rikutud ja koopteeritud mehhanismidega, mis ei sõltu genoomi ebastabiilsusest ja geenimutatsioonidest. Vähigraafika kaubamärgid võeti üle Hanahanilt ja Weinbergilt (2).
Muidugi on geeniekspressiooni mittemutatsioonilise epigeneetilise regulatsiooni kontseptsioon embrüonaalset arengut, diferentseerumist ja organogeneesi vahendava keskse mehhanismina hästi välja kujunenud (53-55). Täiskasvanu puhul hõlmab pikaajaline mälu näiteks muutusi geenide ja histooni modifikatsioonides, kromatiini struktuuris ja geeniekspressiooni lülitite käivitamises, mida positiivse ja negatiivse tagasiside ahelad aja jooksul stabiilselt säilitavad (56, 57). Üha rohkem tõendeid toetab ideed, et analoogsed epigeneetilised muutused võivad kaasa aidata iseloomulike võimete omandamisele kasvaja arengu ja pahaloomulise progresseerumise ajal. Selle hüpoteesi toetamiseks on allpool toodud mõned näited.
Epigeneetilise ümberprogrammeerimise mikrokeskkonna mehhanismid
Kui mitte ainult onkogeensete mutatsioonide kaudu, kuidas siis vähirakkude genoomi ümber programmeeritakse? Üha suurem hulk tõendeid viitab sellele, et kasvaja mikrokeskkonna ebanormaalsed füüsikalised omadused võivad põhjustada ulatuslikke muutusi epigenoomis, millest omaduste fenotüübilise valiku jaoks kasulikud muutused võivad viia vähirakkude kloonilise väljakasvuni, millel on parem sobivus proliferatiivseks laienemiseks.
Kasvajate (või kasvajate piirkondade) ühine tunnus on ebapiisava vaskularisatsiooni tagajärjel tekkinud hüpoksia. Hüpoksia näiteks vähendab TET-demetülaaside aktiivsust, mis toob kaasa olulisi muutusi metüloomis, eriti hüpermetülatsiooni (58). Ebapiisav vaskularisatsioon piirab tõenäoliselt ka kriitiliste vere kaudu levivate toitainete biosaadavust ning näiteks on näidatud, et toitainete deprivatsioon muudab translatsioonikontrolli ja suurendab sellest tulenevalt rinnavähirakkude pahaloomulist fenotüüpi (59).
Hüpoksia poolt vahendatud epigeneetilise regulatsiooni veenev näide on alati surmaga lõppeva laste ependümoomi vorm. Nagu paljudel embrüonaalsetel ja pediaatrilistel kasvajatel, puuduvad sellel vormil korduvad mutatsioonid, eriti juhimutatsioonide puudumine onkogeenides ja kasvaja supressorites. Pigem on näidatud, et nende vähirakkude ebanormaalset kasvu kontrollib hüpoksiast põhjustatud geeniregulatsiooni programm (60, 61). Tähelepanuväärne on see, et selle vähi oletatav päritolurakk asub hüpoksilises sektsioonis ja tõenäoliselt sensibiliseerib selles olevaid rakke, et algatada tuumorigeneesi veel tundmatute kofaktorite kaudu.
Veel üks veenev tõend mikrokeskkonna vahendatud epigeneetilise regulatsiooni kohta puudutab vähirakkude invasiivset kasvuvõimet. Klassikaline näide on vähirakkude invasiivsuse pöörduv esilekutsumine paljude tahkete kasvajate servades, mida juhib arengut reguleeriv programm, mida tuntakse epiteeli-mesenhümaalseks üleminekuks (EMT; viited 62–64). Nimelt näidati hiljuti, et EMT põhiregulaator ZEB1 indutseerib histooni metüültransferaasi SETD1B ekspressiooni, mis omakorda säilitab ZEB1 ekspressiooni positiivse tagasiside ahelas, mis säilitab EMT (invasiivse) regulatiivse seisundi (65).
Eelnev uuring dokumenteeris sarnaselt, et EMT esilekutsumine seotud TF-i SNAIL1 ülesreguleeritud ekspressiooni kaudu põhjustas kromatiini maastikus märkimisväärseid muutusi mitmete kromatiini modifikaatorite indutseerimise tulemusena, mille aktiivsus osutus vajalikuks fenotüübilise oleku säilitamiseks (66). Lisaks võivad mitmed tingimused ja tegurid, mida vähirakud kogevad kasvajate servades, sealhulgas hüpoksia ja stroomarakkude poolt sekreteeritud tsütokiinid, ilmselt indutseerida EMT-d ja seega invasiivsust (67, 68).
Ilmekas näide invasiivsuse programmeerimisest mikrokeskkonna poolt, mis väidetavalt ei ole EMT programmiga seotud, hõlmab neuronaalse signaaliahela autokriinset aktiveerimist, mis hõlmab sekreteeritud glutamaati ja selle retseptorit NMDAR (69, 70). Tähelepanuväärne on see, et paljude tahkete kasvajate prototüüpne jäikus, mis väljendub nendes rakke ümbritseva rakuvälise maatriksi (ECM) ulatuslikes muutustes, mõjutab sügavalt vähirakkude invasiivseid ja muid fenotüüpseid omadusi.
Võrreldes normaalse koe ECM-iga, millest kasvajad tekivad, iseloomustab kasvaja ECM-i tavaliselt suurenenud ristsidumine ja tihedus, ensümaatilised modifikatsioonid ja muutunud molekulaarne koostis, mis korraldavad kollektiivselt osaliselt ECM-i motiivide integriiniretseptorite kaudu, jäikus-indutseeritud signaaliülekande- ja geeniekspressioonivõrgustikud, mis kutsuvad esile invasiivsuse (71 ja muud iseloomulikud tunnused).
Lisaks sellistele regulatiivsetele mehhanismidele, mida toetab kasvaja füüsiline mikrokeskkond, võib parakriinne signaalimine, mis sisaldab lahustuvaid faktoreid, mida eraldavad rakuvälisesse miljöösse tahkeid kasvajaid asustavate erinevate rakutüüpide poolt, kaasa aidata mitmete morfoloogiliselt erinevate invasiivsete kasvuprogrammide esilekutsumisele (72), millest ainult üks, mida nimetatakse epigeneetiliseks, näib olevat seotud "mesenhüümiliseks" EMT regulatsioonimehhanism.
Epigeneetiline regulatiivne heterogeensus
Kasvav teadmistebaas suurendab tunnustust kasvajasisese heterogeensuse tähtsuse suhtes fenotüübilise mitmekesisuse loomisel, kus proliferatiivseks laienemiseks ja invasiooniks kõige sobivamad rakud kasvavad välja oma vendadest ja valitakse seetõttu pahaloomulise progresseerumise jaoks. Kindlasti on selle fenotüübilise heterogeensuse üks tahk tingitud kroonilisest või episoodilisest genoomsest ebastabiilsusest ja sellest tulenevalt kasvajat asustavate rakkude geneetilisest heterogeensusest.
Lisaks saab üha selgemaks, et võib esineda mittemutatsioonipõhine epigeneetiline heterogeensus. Silmapaistev näide on linkerhistoon H1.0, mida ekspresseeritakse ja represseeritakse dünaamiliselt vähirakkude alampopulatsioonides mitmesugustes kasvajatüüpides, mille tulemuseks on megabaasi suuruste domeenide sekvestreerimine või juurdepääsetavus [73]. Eelkõige leiti, et represseeritud H1.0 vähirakkude populatsioonil on tüvilaadsed omadused, paranenud kasvaja initsiatsioonivõime ja seos patsientide halva prognoosiga.
Veel ühte epigeneetiliselt reguleeritud plastilisuse näidet on kirjeldatud inimese suukaudsete lamerakuliste kartsinoomide (SCC) puhul, kus invasiivsete servade vähirakud võtavad osalise EMT oleku (p-EMT), millel puuduvad ülalnimetatud mesenhümaalsed TF-id, kuid mis ekspresseerivad teisi EMT-d määravaid geene, mis ei ekspresseeru kasvajate keskses tuumas (74).
Ilmselgelt ei esinda p-EMT rakud mutatsiooniga muudetud rakkude klonaalset jaotumist: primaarsete kasvajate vähirakkude kultuurid sisaldavad nii p-EMT hi ja p-EMT lo rakkude dünaamilisi segusid ning kui p-EMT hi/lo rakud FACS-i puhastati ja kultiveeriti, muutusid mõlemad p-EMT hi ja p-EMT lo segapopulatsioonideks 4 päeva jooksul. Kuigi külgnevast stroomast pärit parakriinseid signaale võib pidada p-EMT hi oleku suhtes deterministlikuks, viitab kahe epigeneetilise oleku stabiilne olemasolu ja regenereerimine kultuuris vähirakkudele omase mehhanismi olemasolule. Eelkõige toetab seda järeldust 198 rakuliini analüüs, mis esindavad 22 vähitüüpi, sealhulgas SCC, kus rakuliini mudelites ja nendega seotud primaarsetes kasvajates tuvastati erinevalt 12 stabiilselt heterogeenset epigeneetilist seisundit (sealhulgas p-EMT SCC-s) (75).
Jällegi, heterogeenseid fenotüüpseid olekuid ei saanud seostada tuvastatavate geneetiliste erinevustega ja mitmel juhul on näidatud, et konkreetse oleku FACS-sorteeritud rakud tasakaalustavad dünaamiliselt uuesti kultuuri, koondades stabiilse tasakaalu algsetes rakuliinides täheldatud heterogeensete olekute vahel.
Lisaks valgustavad tehnoloogiad erinevate atribuutide genoomi hõlmavaks profileerimiseks – peale DNA järjestuse ja selle mutatsiooni variatsiooni – vähirakkude genoomi annotatsiooni ja korralduse mõjukaid elemente, mis on korrelatsioonis patsiendi prognoosiga ja üha enam iseloomulike võimetega (76–78). Epigenoomset heterogeensust paljastavad üha võimsamad tehnoloogiad kogu genoomi hõlmava DNA metüülimise (79, 80), histooni modifitseerimise (81), kromatiini ligipääsetavuse (82) ning RNA transkriptsioonijärgse modifikatsiooni ja translatsiooni (83, 84) profileerimiseks (83, 84).
Siin vaadeldava postulaadiga seotud väljakutseks on kindlaks teha, millised epigenoomilised modifikatsioonid teatud vähitüüpides (i) omavad regulatiivset tähtsust ja (ii) esindavad puhtalt mittemutatsioonilist ümberprogrammeerimist, erinevalt mutatsioonist tingitud ja seega genoomiga seletatavast ebastabiilsusest.
Kasvaja mikrokeskkonda asustavate stromaalsete rakutüüpide epigeneetiline regulatsioon
Üldiselt arvatakse, et kasvaja mikrokeskkonnas olevad lisarakud, mis funktsionaalselt aitavad kaasa iseloomulike võimete omandamisele, ei kannata geneetilise ebastabiilsuse ja mutatsiooni ümberprogrammeerimise all, et tugevdada nende kasvajat soodustavat toimet; pigem jõutakse järeldusele, et need rakud – vähiga seotud fibroblastid, kaasasündinud immuunrakud ning kasvaja veresoonkonna endoteelirakud ja peritsüüdid – programmeeritakse nende värbamisel epigeneetiliselt ümber lahustuvate ja füüsikaliste tegurite poolt, mis määravad tahke kasvaja mikrokeskkonna (2, 85).
Eeldatakse, et praegu vähirakkudele rakendatavaid multi-omic profiilide koostamise tehnoloogiaid hakatakse üha enam kasutama kasvajate lisarakkude (strooma) uurimiseks, et selgitada välja, kuidas normaalsed rakud on kahjustatud, et funktsionaalselt toetada kasvaja arengut ja progresseerumist. Näiteks viitab hiljutine uuring (86), et selline ümberprogrammeerimine võib hõlmata epigenoomi modifikatsioone, lisaks tsütokiinide, kemokiinide ja kasvufaktorite induktiivsele vahetusele, mis muudavad rakusiseseid signaalivõrke kõigis nendes rakutüüpides:
Kui kopsumetastaasidega hiiremudeleid töödeldi DNA metüültransferaasi inhibiitori (5-asatsütidiini) ja histooni modifitseerimise inhibiitori (HDAC) kombinatsiooniga, leiti, et infiltreeruvad müeloidrakud on muutunud ebaküpsest (kasvajat soodustavast) eellasseisundist rakkudesse, mis meenutavad küpset interstitsiaalset (kasvajataolist, mitte-kasvajat agonisteerivat) kasvajad, ei suutnud toetada tüüpilisi võimeid, mis on vajalikud tõhusaks metastaatiliseks koloniseerimiseks (86). On mõeldav, et multi-oomiline profiilide koostamine ja farmakoloogilised häired aitavad selgitada ümberprogrammeeritud epigeneetilist olekut sellistes müeloidrakkudes, aga ka muudes iseloomulikes lisarakkude tüüpides, mis asustavad kasvaja mikrokeskkondi.
Kokkuvõte
Kokkuvõttes toetavad need illustreerivad hetktõmmised teesi, et epigeneetilist ümberprogrammeerimist ilma mutatsioonita peetakse tõeliseks võimaldavaks tunnuseks, mis hõlbustab iseloomulike võimete omandamist (joonis 3), mis erinevad genoomse DNA ebastabiilsusest ja mutatsioonist. Eelkõige võib eeldada, et mittemutatsiooniline epigeneetiline ümberprogrammeerimine osutub lahutamatuks ülalkirjeldatud fenotüübilise plastilisuse esialgse uue eristava võime võimaldamisel, eriti kui dünaamilise transkriptoomilise heterogeensuse liikumapanev jõud, mis on pahaloomuliste vähirakkude TME-de puhul üha paremini dokumenteeritud. Üherakuliste multi-oomiliste profiilide koostamise tehnoloogiate areng heidab valgust vastavatele panustele ja vastasmõjule mutatsioonidest juhitud ja mittemutatsioonist juhitud epigeneetilise regulatsiooni vahel kasvajate arengus pahaloomulise progresseerumise ja metastaaside ajal.
Polümorfsed mikrobioomid
Biomeditsiini kaugeleulatuv piir on avanemas, valgustades mikroorganismide, mida ühiselt nimetatakse mikrobiootaks, mitmekesisust ja varieeruvust, mis seostuvad sümbiootiliselt väliskeskkonnaga kokkupuutuvate keha barjääride kudedega – eriti seedetrakti epidermise ja sisemise limaskestaga, samuti rinna- ja urogenitaalsüsteemiga.
Üha enam tunnistatakse, et kohalike bakterite ja seente loodud ökosüsteemidel – mikrobioomidel – on sügav mõju tervisele ja haigustele ( 87 ), mis on ajendatud võimalusest skriinida mikroobiliikide populatsioone järgmise põlvkonna sekveneerimis- ja bioinformaatikatehnoloogiate abil. Vähi puhul muutuvad üha veenvamaks tõendid selle kohta, et mikrobioomide polümorfne varieeruvus populatsiooni üksikisikute vahel võib avaldada sügavat mõju vähi fenotüüpidele (88, 89).
Assotsiatsiooniuuringud inim- ja eksperimentaalsetes manipulatsioonides vähi hiiremudelitega näitavad teatud mikroorganisme, peamiselt, kuid mitte ainult baktereid, millel võib olla kaitsev või kahjulik mõju vähi arengule, pahaloomulisele progresseerumisele ja ravivastusest. See kehtib ka koe mikrobioomi kui terviku globaalse keerukuse ja koostise kohta. Kuigi soolestiku mikrobioom oli selle uue piiri teerajaja, on mitmete kudede ja elunditega seotud mikrobioome, millel on populatsiooni dünaamika ning mikroobiliikide ja alamliikide mitmekesisusega seotud eripärad.
See kasvav arusaam polümorfselt muutuvate mikrobioomide tähtsusest tervises ja haigustes tõstatab küsimuse: kas mikrobioom on eraldiseisev võimaldav tunnus, mis mõjutab nii positiivselt kui ka negatiivselt vähktõve eristavate võimete omandamist? Ma kaalun seda võimalust allpool ja illustreerin tõendeid mõne silmapaistva koe mikrobioomi kohta, mis on seotud vähktõve tunnustega (joonis 4), alustades kõige silmapaistvamast ja ilmselt kõige mõjukamast mikrobioomist, milleks on sooletrakt.
Joonis 4
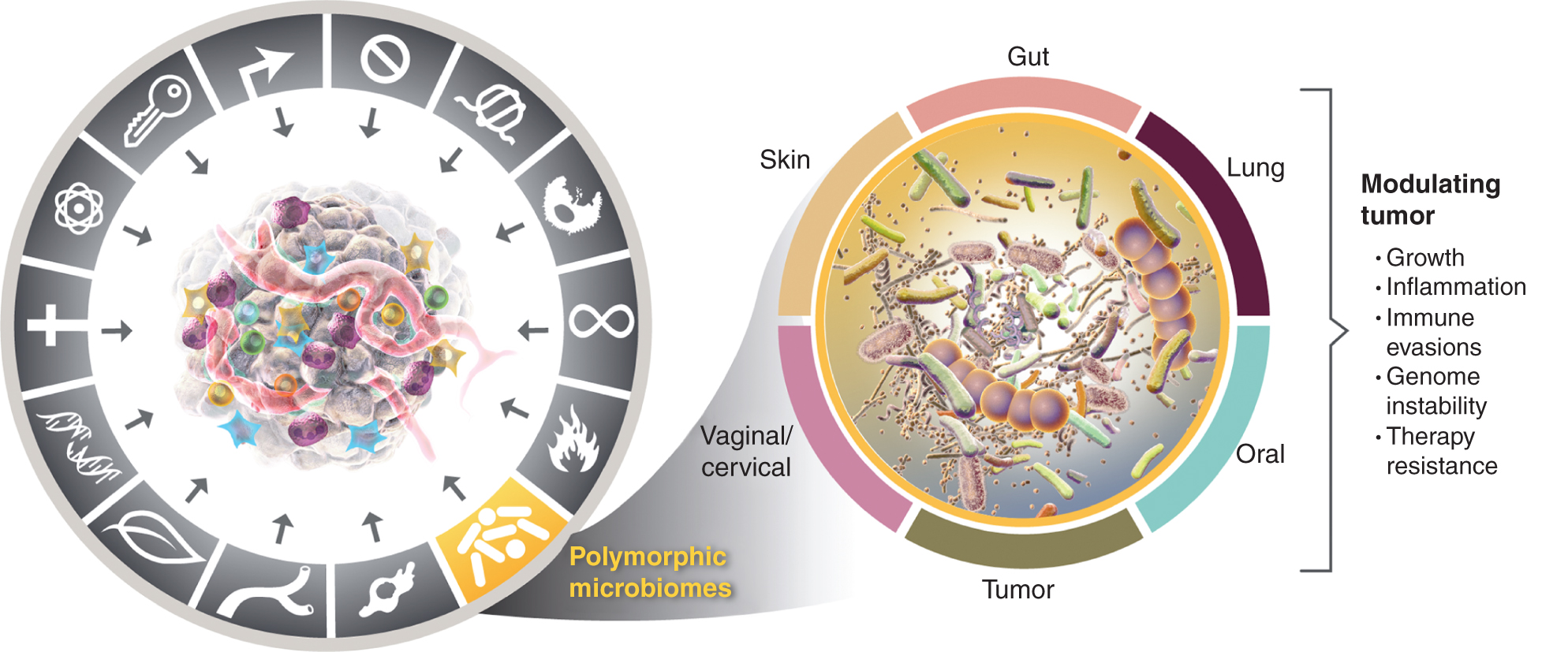
Vasakul, kuigi kasvajat soodustava põletiku ja genoomse ebastabiilsuse ja mutatsioonide omadused kattuvad, on üha enam põhjust järeldada, et polümorfsed mikrobioomid, mis paiknevad ühes indiviidis võrreldes teisega jämesooles, teistes limaskestades ja nendega seotud organites või kasvajates endis, võivad mõjutada paljusid iseloomulikke võimeid mitmel erineval viisil – kas induktsiooni või inhibeerimise kaudu. vähk areneb, areneb ja kasvab reageerib ravile. Tõsi, kasvaja fenotüüpide moduleerimises osalevad mitmed koe mikrobioomid. Lisaks laialdaselt uuritud soolestiku mikrobioomile osalevad teatud kasvajatüüpidele iseloomulike võimete omandamise – nii positiivsete kui negatiivsete – moduleerimises ka muud iseloomulikud koe mikrobioomid ja kasvaja mikrobioom. Vähigraafika kaubamärgid võeti üle Hanahanilt ja Weinbergilt (2).
Soole mikrobiomi mitmekordne moduleeriv toime
On juba ammu teada, et soolestiku mikrobioom on jämesoole (käärsoole) funktsioonide jaoks ülioluline metaboolse homöostaasi osana toitainete lagundamisel ja kehasse importimisel ning et mikroobipopulatsioonide häire (düsbioos) käärsooles võib põhjustada mitmesuguseid füsioloogilisi haigusi (87). See hõlmab kahtlust, et käärsoolevähi vastuvõtlikkust, arengut ja patogeneesi mõjutab soolestiku mikrobioom. Viimastel aastatel on veenvad funktsionaalsed uuringud, milles kasutati käärsoole kasvajaga patsientide ja hiirte väljaheite siirdamist käärsoolevähi tekkeks eelsoodumusega retsipienthiirtesse, kehtestanud põhimõtte: on olemas nii vähki kaitsvad kui ka kasvajat soodustavad mikrobioomid, mis hõlmavad spetsiifilisi bakteriliike, mis võivad moduleerida käärsoole kasvajate esinemist ja patogeneesi (90).
Mehhanismid, mille abil mikrobioota neid moduleerivaid rolle annab, on endiselt selgitamisel, kuid kaks üldist mõju on kasvajaid soodustavate mikrobioomide ja mõnel juhul ka spetsiifiliste kasvajat soodustavate bakteriliikide jaoks üha paremini kindlaks tehtud. Esimene efekt on käärsoole epiteeli mutagenees bakteriaalsete toksiinide ja muude molekulide tootmise tulemusena, mis kas otseselt kahjustavad DNA-d või häirivad süsteeme, mis säilitavad genoomse terviklikkuse või muul viisil stressirakke, mõjutades kaudselt DNA replikatsiooni ja parandamise täpsust. Tüüpiline näide on E. coli, mis kannab PKS-lookust, mis on näidanud, et see mutageniseerib inimese genoomi ja osaleb märki võimaldavate mutatsioonide edastamises (91).
Lisaks on teatatud, et bakterid seonduvad käärsoole epiteelirakkude pinnaga ja toodavad ligandimimeetikume, mis stimuleerivad epiteeli proliferatsiooni, aidates kaasa neoplastiliste rakkude iseloomulikule proliferatiivsele signaaliülekandevõimele (88). Teine mehhanism, mille abil teatud tüüpi bakterid soodustavad kasvaja arengut, on butüraati tootvad bakterid, mille arvukus on suurenenud kolorektaalse vähiga patsientidel (92).
Metaboliidi butüraadi tootmisel on keerukad füsioloogilised toimed, sealhulgas vananevate epiteeli- ja fibroblastirakkude indutseerimine. Butüraati tootvate bakteritega koloniseeritud käärsoole kantserogeneesi hiiremudelil tekkis rohkem kasvajaid kui hiirtel, kellel sellised bakterid puudusid; Seost butüraadist põhjustatud vananemise ja suurenenud käärsoole tuumorigeneesi vahel on tõestatud senolüütilise ravimi kasutamisega, mis tapab vananevaid rakke, kahjustades kasvaja kasvu (92).
Lisaks on bakterite toodetud butüraadil pleiotroopne ja paradoksaalne toime diferentseerunud rakkudele, võrreldes käärsoole epiteeli diferentseerumata (tüvi)rakkudega tingimustes, kus soolebarjäär on rikutud (düsbioos) ja bakterid on invasiivsed, mõjutades näiteks raku energiat ja ainevahetust, histooni modifitseerimist, rakutsükli progresseerumist ja immuunsüsteemi kohanemist soodustavat põletikku. immuunvastused (93).
Tõepoolest, polümorfsete mikrobioomide laiaulatuslik toime hõlmab adaptiivse ja kaasasündinud immuunsüsteemi moduleerimist erinevate radade kaudu, sealhulgas "immunomoduleerivate" faktorite tootmine bakterite poolt, mis aktiveerivad epiteeli- või immuunrakkude kahjustusandureid, mis viib mitmekesise kemokiinide ja tsütokiinide repertuaari ekspressioonini ning immuunkolliumi rakkude populatsiooni ja epideemiat kujundavaid omadusi. aluseks olev strooma ja dreneerivad lümfisõlmed.
Lisaks võivad teatud bakterid rikkuda nii kaitsvat biokilet kui ka käärsoole epiteeli vooderdavat lima ning häirida epiteelirakkude ja rakkude tihedaid ühendusi, mis ühiselt säilitavad füüsilise barjääri, mis tavaliselt eraldab soolestiku mikrobioomi. Stroomasse tungimisel võivad bakterid vallandada nii kaasasündinud kui ka adaptiivseid immuunvastuseid, kutsudes esile tsütokiinide ja kemokiinide repertuaari sekretsiooni. Üheks ilminguks võib olla kasvajat soodustavate või kasvajaid antagonistlike immuunmikrokeskkondade loomine, mis järelikult kaitsevad kasvaja teket ja pahaloomulist progresseerumist või soodustavad seda.
Seega võib (i) (kaasasündinud) kasvajat soodustava põletiku esilekutsumise ja (ii) iseloomulike mikrobioomide poolt (adaptiivse) immuundestruktsiooni eest põgenemise põimunud parameetrite moduleerimine üksikutel patsientidel olla seotud mitte ainult prognoosiga, vaid ka vastuse või resistentsusega immuunteraapiale immuunkontrollpunkti inhibiitoritega ja kasvaja muude terapeutiliste ilmingute tekkega mikrokeskkonnad, mis järelikult tekivad Kaitsevad või soodustavad kasvaja arengut ja pahaloomulise progresseerumist.
Seega võib (i) (kaasasündinud) kasvajat soodustava põletiku esilekutsumise ja (ii) iseloomulike mikrobioomide poolt (adaptiivse) immuundestruktsiooni eest põgenemise põimunud parameetrite moduleerimine üksikutel patsientidel olla seotud mitte ainult prognoosiga, vaid ka vastuse või resistentsusega immuunteraapiale immuunkontrollpunkti inhibiitoritega ja kasvaja muude terapeutiliste ilmingute tekkega mikrokeskkonnad, mis järelikult esinevad, kaitsevad või soodustavad kasvaja arengut ja pahaloomulise progresseerumist).
Seega võib üksikute patsientide (i) (kaasasündinud) kasvajat soodustava põletiku esilekutsumise ja (ii) (adaptiivse) immuunkahjustuse eest põgenemise parameetrite moduleerimine üksikutel patsientidel olla seotud mitte ainult prognoosiga, vaid ka vastuse või resistentsusega immuunravile immuunkontrollpunkti inhibiitorite ja muude ravimeetoditega (89, 94). Kontseptsiooni esialgne tõestus pärineb hiljutistest uuringutest, mis näitavad immunoteraapia efektiivsuse taastumist pärast fekaalse mikrobiota siirdamist ravile reageerivatelt patsientidelt melanoomiga patsientidele, kes olid varasema immuunkontrollpunkti blokaadiga ravi ajal progresseerunud (97, 98).
Molekulaarsed mehhanismid, mille abil soolestiku mikrobiomi erinevad ja varieeruvad komponendid süsteemselt moduleerivad adaptiivse immuunsüsteemi aktiivsust, jäävad püsivaks saladuseks, kas tugevdades immuunkontrollpunkti blokaadi poolt esile kutsutud kasvajavastaseid immuunvastuseid või pigem kutsudes esile süsteemse või lokaalse (intratumoraalse) immunosupressiooni. Hiljutine uuring on andnud valgust: teatud Enterococcus'i (ja teiste bakterite) tüved ekspresseerivad peptidoglükaani hüdrolüaasi nimega SagA, mis vabastab bakteriseinast mukopeptiide, mis võivad seejärel süsteemselt ringelda ja aktiveerida NOD2 mustri retseptori, mis omakorda suurendab T-rakkude vastuseid ja kontrollpunkti immunoteraapia efektiivsust (99).
Tuvastatakse ja hinnatakse funktsionaalselt teisi spetsiifiliste bakterite alamliikide poolt toodetud immunoregulatoorseid molekule, sealhulgas bakterite toodetud inosiin, T-rakkude aktiivsuse kiirust piirav metaboliit (100). Need ja teised näited hakkavad piiritlema molekulaarseid mehhanisme, mille abil polümorfsed mikrobioomid moduleerivad kaudselt ja süsteemselt tuumori immunobioloogiat, lisaks immuunvastustele, mis järgnevad bakterite otsesele füüsilisele koostoimele immuunsüsteemiga (101, 102).
Lisaks põhjuslikele seostele käärsoolevähi ja melanoomiga on soolestiku mikrobioomi tõestatud võime kutsuda esile immunomoduleerivate kemokiinide ja tsütokiinide ekspressioon, mis sisenevad süsteemsesse vereringesse, samuti ilmselt võimeline mõjutama vähi patogeneesi ja reageerimist ravile teistes kehaorganites (94, 95).
Valgustav näide puudutab kolangiokartsinoomide arengut maksas: soole düsbioos võimaldab bakterite ja bakteriaalsete saaduste sisenemist ja transportimist portaalveeni kaudu maksa, kus hepatotsüütides ekspresseeritud TLR4 käivitatakse, et indutseerida kemokiini CXCL1 ekspressioon, mis värbab CXCR2 ekspresseerivaid rakke, mis teenivad looduslikke granulotsüütiliste kiudrakkude (sumppresso) rakke. vältida immuunkahjustust (103) ja tõenäoliselt edasi anda muid eristavaid võimeid (85). Sellisena on soolestiku mikrobioom selgelt seotud võimaldava funktsioonina, mis võib alternatiivselt hõlbustada või kaitsta mitme vähi eest.
Väljaspool soolestikku: erinevate mikrobioomide kaasamine teistesse barjääri kudedesse
Peaaegu kõik koed ja elundid, mis on otseselt või kaudselt väliskeskkonnaga kokku puutunud, on ühtlasi kommensaalsete mikroorganismide hoidlad (104). Vastupidiselt soolestikule, kus mikrobioomi sümbiootiline roll ainevahetuses on hästi äratuntav, on nendes erinevates kohtades elava mikrobiota normaalne ja patogeenne roll endiselt esile kerkimas.
Homöostaasi, vananemise ja vähiga seotud mikrobioomide koostises on ilmseid elundi-/koespetsiifilisi erinevusi, kusjuures nii kattuvad kui ka eristuvad liigid ja sagedused käärsoole omadega (104, 105). Lisaks annavad assotsiatsiooniuuringud üha rohkem tõendeid selle kohta, et lokaalsed kasvajat antagoniseerivad/kaitsvad versus kasvajat soodustavad kudede mikrobioomid, mis on sarnased soolestiku mikrobioomiga, võivad moduleerida vastuvõtlikkust ja patogeneesi nendega seotud elundites tekkivatele inimese vähkkasvajatele (106–109).
Kasvajasisese mikrobiota mõju?
Lõpuks on patoloogid juba ammu tunnistanud, et baktereid saab tuvastada tahketes kasvajates, mida on nüüdseks tõestanud keerukad profiilide koostamise tehnoloogiad. Näiteks uuringus 1526 kasvajaga, mis hõlmasid seitset inimese vähitüüpi (luu-, aju-, rinna-, kopsu-, melanoom-, munasarja- ja kõhunäärmevähk), iseloomustas igat tüüpi omanäoline mikrobioom, mis paiknes peamiselt vähirakkudes ja immuunrakkudes. Iga kasvajatüübi puhul on näidatud kasvaja mikrobioomi variatsioone ja järeldati, et need on seotud kliiniliste patoloogiliste tunnustega (110).
Mikrobioota on sarnaselt tuvastatud de novo geneetiliselt muundatud kopsu- ja kõhunäärmevähi hiiremudelites ning nende puudumine mikroobivabadel hiirtel ja/või nende tühistamine antibiootikumidega võib kahjustada tuumorigeneesi, kaasates kasvaja mikrobioomi funktsionaalselt kasvajat soodustava põletiku ja pahaloomulise progresseerumise eelkäijana (11211).
Inimese pankrease duktaalse adenokartsinoomi seosuuringud ja funktsionaalsed testid väljaheite siirdamisega kasvajaga hiirtele on näidanud, et kasvaja mikrobioomi ja sellega seotud soolestiku mikrobioomi variatsioonid moduleerivad immuunsüsteemi fenotüüpe ja ellujäämist (113). Tuleviku oluliseks väljakutseks on laiendada neid mõjusid teistele kasvajatüüpidele ja eraldada potentsiaalselt eraldatavad panused kasvaja mikrobioomi konstitutsiooni ja varieerumise osas soolestiku mikrobioomi (ja kohaliku päritolukoe) omadest, võib-olla tuvastades konkreetsed mikroobiliigid, mis on ühes või teises kohas funktsionaalselt mõjukad.
Kokkuvõte
Tuleviku intrigeerivad küsimused hõlmavad seda, kas erinevates kudedes või tekkivates kasvajates asuv mikrobioota on võimeline kaasa aitama või häirima muude eristavate võimete omandamist peale immunomodulatsiooni ja genoomse mutatsiooni, mõjutades seeläbi kasvaja arengut ja progresseerumist. On tõendeid selle kohta, et teatud bakteriliigid võivad otseselt stimuleerida proliferatiivse signaaliülekande tunnusjoont, näiteks käärsoole epiteelis (88) ja moduleerida kasvu pärssimist, muutes kasvaja supressori aktiivsust soolestiku erinevates osades (114), samal ajal kui see avaldab otsest mõju teistele iseloomulikele võimetele, nagu rakusurma vältimine, metastaaside üldine käivitamine, angiogeneesi häire ja stimuleerimine. nendest tähelepanekutest inimese vähi mitmete vormide kohta.
Sellest hoolimata on üha kaalukamaid argumente selle kohta, et soolestiku ja teiste organite mikrobioomide polümorfne varieerumine kujutab endast iseloomulikku aktiveerivat tunnust eristavate oskuste omandamiseks (joonis 4), isegi kui see kattub genoomi ebastabiilsuse ja mutatsioonidega ning kasvajat soodustava põletikuga ja täiendab neid.
Vananevad rakud
Rakkude vananemine on tüüpiliselt pöördumatu proliferatsiooni peatamise vorm, mis tõenäoliselt arenes välja kaitsemehhanismina koe homöostaasi säilitamiseks, näiliselt täiendava mehhanismina programmeeritud rakusurmale, mis aitab inaktiveerida ja õigeaegselt eemaldada haiged, düsfunktsionaalsed või muul viisil mittevajalikud rakud. Lisaks rakkude jagunemistsükli väljalülitamisele põhjustab vananemisprogramm muutusi raku morfoloogias ja ainevahetuses ning kõige sügavamalt vananemisega seotud sekretoorse fenotüübi (SASP) aktiveerimist, mis hõlmab paljude bioaktiivsete valkude, sealhulgas kemokiinide vabanemist.
Tsütokiinid ja proteaasid, mille identsus sõltub raku- ja koetüübist, millest vananev rakk tekib (115–117). Rakkudes võivad vananemist esile kutsuda mitmesugused tingimused, sealhulgas mikrokeskkonna stressid, nagu toitainete nälg ja DNA kahjustused, samuti organellide ja raku infrastruktuuri kahjustused ning rakuliste signaalivõrkude tasakaalustamatused (115, 117), mis kõik on toimunud seoses täheldatud vananevate rakkude sageduse suurenemisega (erinevates elundites18).
Rakkude vananemist on pikka aega peetud kaitsemehhanismiks neoplaasia vastu, mis põhjustab vähirakkude vananemist (120). Suurem osa ülalnimetatud vananemisprogrammi algatajatest on seotud pahaloomuliste kasvajatega, eelkõige hälbiva hüperproliferatsiooni tagajärjel tekkinud DNA kahjustusega, nn onkogeenist põhjustatud vananemisega hüperaktiveeritud signalisatsiooni tõttu ning teraapiast põhjustatud vananemisega keemia- ja kiiritusravist põhjustatud raku- ja genoomikahjustuste tagajärjel.
Tõepoolest, on väljakujunenud näiteid vananemise kaitsvatest eelistest pahaloomulise progresseerumise piiramisel (118, 119). Vastupidi, kasvav hulk tõendeid näitab vastupidist: teatud kontekstides stimuleerivad vananevad rakud erinevalt kasvaja arengut ja pahaloomulise kasvaja progresseerumist (119, 121).
Arusaadavas juhtumiuuringus eemaldati vananevatel hiirtel vananevad rakud farmakoloogiliselt, vähendades spetsiifiliselt rakutsükli inhibiitorit p16 – INK4a ekspresseerivaid vananevaid rakke: lisaks mitmete vanusega seotud sümptomite edasilükkamisele põhjustas see vananevate rakkude ammendumise vananevatel hiirtel, vähendades spontaanse tuumori tekke ja surma (vähk-1) teket.
Arvatakse, et peamine mehhanism, mille abil vananevad rakud soodustavad kasvaja fenotüüpe, on SASP, mis on näidanud, et see suudab tüüpiliste võimete vahendamiseks parakriinselt vahendada signaalmolekule (ja proteaase, mis aktiveerivad ja/või deaktiveerivad). Seega on erinevates eksperimentaalsetes süsteemides näidatud, et vananevad vähirakud aitavad erinevatel viisidel kaasa proliferatiivsele signaaliülekandele, väldivad apoptoosi, kutsuvad esile angiogeneesi, stimuleerivad invasiooni ja metastaase ning suruvad maha kasvaja immuunsust (116, 118, 120, 121).
Veel üks vananevate vähirakkude mõju vähi fenotüüpidele hõlmab mööduvaid, pöörduvaid vananeva raku olekuid, mille käigus vananevad vähirakud pääsevad oma SASP-d ekspresseerivast mitteproliferatiivsest seisundist ning jätkavad rakkude proliferatsiooni ja sellega seotud täielikult elujõuliste onkogeenirakkude võimete avaldumist (44).
Sellist mööduvat vananemist on kõige paremini dokumenteeritud raviresistentsuse korral (44), mis kujutab endast vaikimise vormi, mis väldib vohavate vähirakkude terapeutilist sihtimist, kuid võib osutuda tõhusamaks kasvaja arengu, pahaloomulise progresseerumise ja metastaaside muudes etappides.
Lisaks ei piirdu vananevate rakkude tunnuseid soodustavad võimed ainult vananevate vähirakkudega. On näidatud, et vähiga seotud fibroblastid (CAF) vananevad kasvajates, põhjustades vananevaid CAF-e, mis on osutunud kasvajat soodustavaks, andes TME vähirakkudele iseloomulikke võimeid (115, 116, 121).
Lisaks osalevad normaalsetes kudedes vananevad fibroblastid, mis on osaliselt moodustunud loomuliku vananemise või keskkonnakahjustuste tõttu, sarnaselt oma SASP-i kaudu kudede mikrokeskkonna ümberkujundamisega, et pakkuda parakriinset tuge lähedal arenevate kasvajate lokaalsele invasioonile (nn väliefektid) ja kaugetele metastaasidele (116).
Lisaks on näidatud, et vananeva naha vananevad fibroblastid värbavad oma SASP-i kaudu kaasasündinud immuunrakke, mis on nii CD8 T-rakkude poolt ankurdatud adaptiivsete kasvajavastaste immuunvastuste immunosupressiivsed kui ka stimuleerivad nahakasvajate kasvu (123), viimane mõju võib peegeldada selliste kaasasündinud immuunrakkude, nekropofiilsete kapslirakkude (müelofiilsete rakkude) parakriinset panust. peegeldab.
Ehkki vähem hästi välja kujunenud, näib tõenäoline, et teised arvukad stroomarakud, mis asustavad spetsiifilisi kasvaja mikrokeskkondi, vananevad, moduleerides seeläbi vähi omadusi ja sellest tulenevaid kasvaja fenotüüpe. Näiteks võivad teraapiaga indutseeritud vananevad kasvaja endoteelirakud suurendada rinnavähi mudelite proliferatsiooni, invasiooni ja metastaase (124, 125).
Kindlasti nõuavad sellised tõendid teiste kasvajatüüpide uurimist, et hinnata fibroblastide, endoteelirakkude ja teiste stroomarakkude üldist vananemist kasvaja arengu liikumapaneva jõuna. Samuti on praegu ebaselged regulatiivsed mehhanismid ja funktsionaalsed determinandid, mille abil konkreetne vananev rakutüüp konkreetses TME-s kutsub esile kasvajat soodustava versus kasvaja antagoniseeriva SASP, mida saab ilmselt indutseerida alternatiivselt samas vananevas rakutüübis, võib-olla erinevate initsiaatorite poolt, kui see on sukeldutud iseloomulikesse füsioloogilistesse ja neoplastilistesse mikrokeskkondadesse.
Kokkuvõte
Vähi patogeneesis on peetud ülioluliseks kontseptsioon, et kasvajad koosnevad geneetiliselt muundatud vähirakkudest, mis suhtlevad värvatud ja epigeneetiliselt/fenotüüpiliselt rikutud lisarakkudega (stroomarakkudega) ja saavad neist kasu. Eespool käsitletud ja siin (ja mujal) tsiteeritud ülevaadetes ja aruannetes kirjeldatud kaalutlused väidavad veenvalt, et vananevate rakkude (olenemata raku päritolust) tuleks kaaluda nende lisamist kasvaja mikrokeskkonna funktsionaalselt oluliste rakkude loetellu (joonis 5). Seetõttu tuleks vähimehhanismide põhjalike teadmiste otsimisel kaaluda vananevaid rakke. Veelgi enam, nende tähtsuse tunnustamine motiveerib teisejärgulist eesmärki, milleks on kasvajat soodustavate vananevate rakkude terapeutiline sihtimine kõigi konstitutsioonidega, olgu selleks siis farmakoloogiline või immunoloogiline ablatsioon või SASP ümberprogrammeerimine kasvajat antagonistlikeks variantideks (115, 121, 126).
Joonis 5

Heterogeensed vähirakkude alatüübid ning stroomarakkude tüübid ja alatüübid on funktsionaalselt integreeritud kasvajate kui ebaseaduslike elundite ilmingutesse. Üha rohkem tõendeid viitab sellele, et paljude nende TME rakuliste komponentide ja nende muutuvate SASP-de vananevad raku derivaadid on seotud tunnuste võimete ja sellest tulenevate kasvaja fenotüüpide moduleerimisega. Vähigraafika kaubamärgid võeti üle Hanahanilt ja Weinbergilt (2).
Lõppsõna
Kuigi vähi kaheksal iseloomulikul tunnusel ja nende kahel toetaval tunnusel on vähi mõiste kujundamisel püsiv heuristiline väärtus, viitavad ülaltoodud kaalutlused sellele, et mõningal määral võib esineda uusi tahke, mis on seega olulised haiguse keerukuse, mehhanismide ja ilmingute täielikumaks mõistmiseks. Rakendades 10 põhiatribuudist märgatava, kui mitte täieliku sõltumatuse mõõdikut, võib vaielda, et need neli parameetrit – edasisel valideerimisel ja üldistamisel väljaspool esitatud juhtumiuuringuid – võivad olla integreeritud vähiskeemi tunnusjoontesse (joonis 6).
Seetõttu võiks silmapaistvate võimaluste hulka lisada ka rakulise plastilisuse. Kuigi kaheksas tuum ja see uusvõime on mõlemad kontseptuaalselt eristatavad nende määratluse järgi tunnusmärkidena, on nende reguleerimise aspektid mõne ja võib-olla paljude vähivormide puhul vähemalt osaliselt seotud. Näiteks kanoonilised onkogeensed tegurid moduleerivad koordineeritult mitut tunnust mõne kasvajatüübi puhul, sealhulgas
- (I) KRAS ( https://cancer.sanger.ac.uk/cosmic/census-page/KRAS ),
- (II) MYC ( https://cancer.sanger.ac.uk/cosmic/census-page/MYC ),
- (III) NOTCH ( https://cancer.sanger.ac.uk/cosmic/census-page/NOTCH1 ; Ref. 127) und
- (IV) TP53 ( https://cancer.sanger.ac.uk/cosmic/census-page/TP53 )
Joonis 6
Kuvatakse kanoonilised ja eeldatavad uued täiendused "Vähktõve tunnustele". Käesolevas dokumendis tõstatatakse arutelu, arutelu ja eksperimentaalse läbitöötamise ergutamise eesmärgil võimalus, et osa neljast uuest parameetrist või kõik neist tunnistatakse inimese vähi mitmete vormide üldisteks ja seetõttu sobivad vähi tunnuste põhikontseptsiooni integreerimiseks. Vähigraafika kaubamärgid võeti üle Hanahanilt ja Weinbergilt (2).
Lisaks rakulise plastilisuse lisamisele nimekirja saab mittemutatsioonilist epigeneetilist ümberprogrammeerimist ja polümorfseid variatsioone integreerida elundite/kudede mikrobioomidesse mehaaniliste determinantidena – võimaldavate omadustena –, mille kaudu omandatakse eristavad võimed koos kasvajat soodustava põletikuga (mis on osaliselt seotud mikrobioomiga, mis avaldub ülalmainitud mutatsioonides ja muudes mutatsioonides).
Lõpuks võib TME üldiste komponentidena lisada erineva päritoluga vananevaid rakke, sealhulgas vähirakke ja mitmesuguseid stroomarakke, mis funktsionaalselt aitavad kaasa vähi arengule ja pahaloomulisele progresseerumisele, ehkki märkimisväärselt erineval viisil nende mittevananevate vendade omadest. Kokkuvõttes on ette nähtud, et nende esialgsete „eksperimentaalsete õhupallide” kasutuselevõtt stimuleerib vähiuurijate kogukonnas arutelu, arutelu ja edasist eksperimentaalset uurimist vähibioloogia, geneetika ja patogeneesi kontseptuaalsete parameetrite määratlemisel.
Viited
- Hanahan D , Weinberg RA . The hallmarks of cancer. Cell 2000;100:57–70.
- Hanahan D , Weinberg RA . Hallmarks of cancer: the next generation. Cell 2011;144:646–74.
- Yuan S , Norgard RJ , Stanger BZ . Cellular plasticity in cancer. Cancer Discov 2019;9:837–51.
- Barker N , Ridgway RA , van Es JH , van de Wetering M , Begthel H , van den Born M et al . Crypt stem cells as the cells-of-origin of intestinal cancer. Nature 2009;457:608–11.
- Perekatt AO , Shah PP , Cheung S , Jariwala N , Wu A , Gandhi V et al . SMAD4 suppresses WNT-driven dedifferentiation and oncogenesis in the differentiated gut epithelium. Cancer Res 2018;78:4878–90.
- Shih IM , Wang TL , Traverso G , Romans K , Hamilton SR , Ben-Sasson S et al . Top-down morphogenesis of colorectal tumors. Proc Natl Acad Sci U S A 2001;98:2640–5.
- Ordóñez-Morán P , Dafflon C , Imajo M , Nishida E , Huelsken J . HOXA5 counteracts stem cell traits by inhibiting Wnt signaling in colorectal cancer. Cancer Cell 2015;28:815–29.
- Tan SH , Barker N . Stemming colorectal cancer growth and metastasis: HOXA5 forces cancer stem cells to differentiate. Cancer Cell 2015;28:683–5.
- Köhler C , Nittner D , Rambow F , Radaelli E , Stanchi F , Vandamme N et al . Mouse cutaneous melanoma induced by mutant BRaf arises from expansion and dedifferentiation of mature pigmented melanocytes. Cell Stem Cell 2017;21:679–93.
- Shah M , Bhoumik A , Goel V , Dewing A , Breitwieser W , Kluger H et al . A role for ATF2 in regulating MITF and melanoma development. PLoS Genet 2010;6:e1001258.
- Claps G , Cheli Y , Zhang T , Scortegagna M , Lau E , Kim H et al . A transcriptionally inactive ATF2 variant drives melanomagenesis. Cell Rep 2016;15:1884–92.
- Saghafinia S , Homicsko K , Di Domenico A , Wullschleger S , Perren A , Marinoni I et al . Cancer cells retrace a stepwise differentiation program during malignant progression. Cancer Discov 2021;11:2638–57.
- Yu X-X , Qiu W-L , Yang L , Zhang Y , He M-Y , Li L-C et al . Defining multistep cell fate decision pathways during pancreatic development at single-cell resolution. EMBO J 2019;38:e100164.
- de Thé H . Differentiation therapy revisited. Nat Rev Cancer 2018;18:117–27.
- He LZ , Merghoub T , Pandolfi PP . In vivo analysis of the molecular pathogenesis of acute promyelocytic leukemia in the mouse and its therapeutic implications. Oncogene 1999;18:5278–92.
- Warrell RP , de Thé H , Wang ZY , Degos L . Acute promyelocytic leukemia. N Engl J Med 1993;329:177–89.
- Bots M , Verbrugge I , Martin BP , Salmon JM , Ghisi M , Baker A et al . Differentiation therapy for the treatment of t(8;21) acute myeloid leukemia using histone deacetylase inhibitors. Blood 2014;123:1341–52.
- Ferrara FF , Fazi F , Bianchini A , Padula F , Gelmetti V , Minucci S et al . Histone deacetylase-targeted treatment restores retinoic acid signaling and differentiation in acute myeloid leukemia. Cancer Res 2001;61:2–7.
- Kaufman CK , Mosimann C , Fan ZP , Yang S , Thomas AJ , Ablain J et al . A zebrafish melanoma model reveals emergence of neural crest identity during melanoma initiation. Science 2016;351:aad2197.
- Morris JP , Yashinskie JJ , Koche R , Chandwani R , Tian S , Chen C-C et al . α-Ketoglutarate links p53 to cell fate during tumour suppression. Nature 2019;573:595–9.
- Saha SK , Parachoniak CA , Ghanta KS , Fitamant J , Ross KN , Najem MS et al . Mutant IDH inhibits HNF-4α to block hepatocyte differentiation and promote biliary cancer. Nature 2014;513:110–4.
- Dang L , Su S-SM . Isocitrate dehydrogenase mutation and (R)-2-hydroxyglutarate: from basic discovery to therapeutics development. Annu Rev Biochem 2017;86:305–31.
- Waitkus MS , Diplas BH , Yan H . Biological role and therapeutic potential of IDH mutations in cancer. Cancer Cell 2018;34:186–95.
- Phan TG , Croucher PI . The dormant cancer cell life cycle. Nat Rev Cancer 2020;20:398–411.
- Jiang M , Azevedo-Pouly AC , Deering TG , Hoang CQ , DiRenzo D , Hess DA et al . MIST1 and PTF1 collaborate in feed-forward regulatory loops that maintain the pancreatic acinar phenotype in adult mice. Mol Cell Biol 2016;36:2945–55.
- Krah NM , Narayanan SM , Yugawa DE , Straley JA , Wright CVE , MacDonald RJ et al . Prevention and reversion of pancreatic tumorigenesis through a differentiation-based mechanism. Dev Cell 2019;50:744–54.
- Krah NM , De La O J-P , Swift GH , Hoang CQ , Willet SG , Chen Pan F et al . The acinar differentiation determinant PTF1A inhibits initiation of pancreatic ductal adenocarcinoma. eLife 2015;4:e07125.
- Shi G , DiRenzo D , Qu C , Barney D , Miley D , Konieczny SF . Maintenance of acinar cell organization is critical to preventing Kras-induced acinar-ductal metaplasia. Oncogene 2013;32:1950–8.
- Kopp JL , von Figura G , Mayes E , Liu F-F , Dubois CL , Morris JP et al . Identification of Sox9-dependent acinar-to-ductal reprogramming as the principal mechanism for initiation of pancreatic ductal adenocarcinoma. Cancer Cell 2012;22:737–50.
- Julian LM , McDonald AC , Stanford WL . Direct reprogramming with SOX factors: masters of cell fate. Curr Opin Genet Dev 2017;46:24–36.
- Grimm D , Bauer J , Wise P , Krüger M , Simonsen U , Wehland M et al . The role of SOX family members in solid tumours and metastasis. Semin Cancer Biol 2020;67:122–53.
- Mu P , Zhang Z , Benelli M , Karthaus WR , Hoover E , Chen C-C et al . SOX2 promotes lineage plasticity and antiandrogen resistance in TP53- and RB1-deficient prostate cancer. Science 2017;355:84–8.
- Von Hoff DD , LoRusso PM , Rudin CM , Reddy JC , Yauch RL , Tibes R et al . Inhibition of the hedgehog pathway in advanced basal-cell carcinoma. N Engl J Med 2009;361:1164–72.
- Biehs B , Dijkgraaf GJP , Piskol R , Alicke B , Boumahdi S , Peale F et al . A cell identity switch allows residual BCC to survive Hedgehog pathway inhibition. Nature 2018;562:429–33.
- Boumahdi S , de Sauvage FJ . The great escape: tumour cell plasticity in resistance to targeted therapy. Nat Rev Drug Discov 2020;19:39–56.
- Groves SM , Ireland A , Liu Q , Simmons AJ , Lau K , Iams WT et al . Cancer Hallmarks Define a Continuum of Plastic Cell States between Small Cell Lung Cancer Archetypes [Internet]. Systems Biology; 2021 Jan. Available from: http://biorxiv.org/lookup/doi/10.1101/2021.01.22.427865.
- LaFave LM , Kartha VK , Ma S , Meli K , Del Priore I , Lareau C et al . Epigenomic state transitions characterize tumor progression in mouse lung adenocarcinoma. Cancer Cell 2020;38:212–28.
- Marjanovic ND , Hofree M , Chan JE , Canner D , Wu K , Trakala M et al . Emergence of a high-plasticity cell state during lung cancer evolution. Cancer Cell 2020;38:229–46.
- Drapkin BJ , Minna JD . Studying lineage plasticity one cell at a time. Cancer Cell 2020;38:150–2.
- Inoue Y , Nikolic A , Farnsworth D , Liu A , Ladanyi M , Somwar R et al . Extracellular signal-regulated kinase mediates chromatin rewiring and lineage transformation in lung cancer [Internet]. Cancer Biology; 2020 Nov. Available from: http://biorxiv.org/lookup/doi/10.1101/2020.11.12.368522.
- Dravis C , Chung C-Y , Lytle NK , Herrera-Valdez J , Luna G , Trejo CL et al . Epigenetic and transcriptomic profiling of mammary gland development and tumor models disclose regulators of cell state plasticity. Cancer Cell 2018;34:466–82.
- Malta TM , Sokolov A , Gentles AJ , Burzykowski T , Poisson L , Weinstein JN et al . Machine learning identifies stemness features associated with oncogenic dedifferentiation. Cell 2018;173:338–54.
- Miao Z-F , Lewis MA , Cho CJ , Adkins-Threats M , Park D , Brown JW et al . A dedicated evolutionarily conserved molecular network licenses differentiated cells to return to the cell cycle. Dev Cell 2020;55:178–94.
- De Blander H , Morel A-P , Senaratne AP , Ouzounova M , Puisieux A . Cellular plasticity: a route to senescence exit and tumorigenesis. Cancers 2021;13:4561.
- Merrell AJ , Stanger BZ . Adult cell plasticity in vivo: de-differentiation and transdifferentiation are back in style. Nat Rev Mol Cell Biol 2016;17:413–25.
- Baylin SB , Jones PA . Epigenetic determinants of cancer. Cold Spring Harb Perspect Biol 2016;8:a019505.
- Flavahan WA , Gaskell E , Bernstein BE . Epigenetic plasticity and the hallmarks of cancer. Science 2017;357:eaal2380.
- Jones PA , Issa J-PJ , Baylin S . Targeting the cancer epigenome for therapy. Nat Rev Genet 2016;17:630–41.
- Huang S . Tumor progression: Chance and necessity in Darwinian and Lamarckian somatic (mutationless) evolution. Prog Biophys Mol Biol 2012;110:69–86.
- Darwiche N . Epigenetic mechanisms and the hallmarks of cancer: an intimate affair. Am J Cancer Res 2020;10:1954–78.
- Feng Y , Liu X , Pauklin S . 3D chromatin architecture and epigenetic regulation in cancer stem cells. Protein Cell 2021;12:440–54.
- Nam AS , Chaligne R , Landau DA . Integrating genetic and non-genetic determinants of cancer evolution by single-cell multi-omics. Nat Rev Genet 2021;22:3–18.
- Bitman-Lotan E , Orian A . Nuclear organization and regulation of the differentiated state. Cell Mol Life Sci CMLS 2021;78:3141–58.
- Goldberg AD , Allis CD , Bernstein E . Epigenetics: a landscape takes shape. Cell 2007;128:635–8.
- Zeng Y , Chen T . DNA methylation reprogramming during mammalian development. Genes 2019;10:257.
- Hegde AN , Smith SG . Recent developments in transcriptional and translational regulation underlying long-term synaptic plasticity and memory. Learn Mem 2019;26:307–17.
- Kim S , Kaang B-K . Epigenetic regulation and chromatin remodeling in learning and memory. Exp Mol Med 2017;49:e281.
- Thienpont B , Van Dyck L , Lambrechts D . Tumors smother their epigenome. Mol Cell Oncol 2016;3:e1240549.
- Gameiro PA , Struhl K . Nutrient deprivation elicits a transcriptional and translational inflammatory response coupled to decreased protein synthesis. Cell Rep 2018;24:1415–24.
- Lin GL , Monje M . Understanding the deadly silence of posterior fossa A ependymoma. Mol Cell 2020;78:999–1001.
- Michealraj KA , Kumar SA , Kim LJY , Cavalli FMG , Przelicki D , Wojcik JB et al . Metabolic regulation of the epigenome drives lethal infantile ependymoma. Cell 2020;181:1329–45.
- Bakir B , Chiarella AM , Pitarresi JR , Rustgi AK . EMT, MET, plasticity, and tumor metastasis. Trends Cell Biol 2020;30:764–76.
- Gupta PB , Pastushenko I , Skibinski A , Blanpain C , Kuperwasser C . Phenotypic plasticity: driver of cancer initiation, progression, and therapy resistance. Cell Stem Cell 2019;24:65–78.
- Lambert AW , Weinberg RA . Linking EMT programmes to normal and neoplastic epithelial stem cells. Nat Rev Cancer 2021;21:325–38.
- Lindner P , Paul S , Eckstein M , Hampel C , Muenzner JK , Erlenbach-Wuensch K et al . EMT transcription factor ZEB1 alters the epigenetic landscape of colorectal cancer cells. Cell Death Dis 2020;11:147.
- Javaid S , Zhang J , Anderssen E , Black JC , Wittner BS , Tajima K et al . Dynamic chromatin modification sustains epithelial-mesenchymal transition following inducible expression of Snail-1. Cell Rep 2013;5:1679–89.
- Serrano-Gomez SJ , Maziveyi M , Alahari SK . Regulation of epithelial-mesenchymal transition through epigenetic and post-translational modifications. Mol Cancer 2016;15:18.
- Skrypek N , Goossens S , De Smedt E , Vandamme N , Berx G . Epithelial-to-mesenchymal transition: epigenetic reprogramming driving cellular plasticity. Trends Genet TIG 2017;33:943–59.
- Li L , Hanahan D . Hijacking the neuronal NMDAR signaling circuit to promote tumor growth and invasion. Cell 2013;153:86–100.
- Li L , Zeng Q , Bhutkar A , Galván JA , Karamitopoulou E , Noordermeer D et al . GKAP acts as a genetic modulator of NMDAR signaling to govern invasive tumor growth. Cancer Cell 2018;33:736–51.
- Mohammadi H , Sahai E . Mechanisms and impact of altered tumour mechanics. Nat Cell Biol 2018;20:766–74.
- Odenthal J , Takes R , Friedl P . Plasticity of tumor cell invasion: governance by growth factors and cytokines. Carcinogenesis 2016;37:1117–28.
- Torres CM , Biran A , Burney MJ , Patel H , Henser-Brownhill T , Cohen A-HS et al . The linker histone H1.0 generates epigenetic and functional intratumor heterogeneity. Science 2016;353:aaf1644.
- Puram SV , Tirosh I , Parikh AS , Patel AP , Yizhak K , Gillespie S et al . Single-cell transcriptomic analysis of primary and metastatic tumor ecosystems in head and neck cancer. Cell 2017;171:1611–24.
- Kinker GS , Greenwald AC , Tal R , Orlova Z , Cuoco MS , McFarland JM et al . Pan-cancer single-cell RNA-seq identifies recurring programs of cellular heterogeneity. Nat Genet 2020;52:1208–18.
- Murtha M , Esteller M . Extraordinary cancer epigenomics: thinking outside the classical coding and promoter box. Trends Cancer 2016;2:572–84.
- Nebbioso A , Tambaro FP , Dell’Aversana C , Altucci L . Cancer epigenetics: moving forward. PLoS Genet 2018;14:e1007362.
- Tavernari D , Battistello E , Dheilly E , Petruzzella AS , Mina M , Sordet-Dessimoz J et al . Non-genetic evolution drives lung adenocarcinoma spatial heterogeneity and progression. Cancer Discov 2021;11:1490–507.
- Heyn H , Vidal E , Ferreira HJ , Vizoso M , Sayols S , Gomez A et al . Epigenomic analysis detects aberrant super-enhancer DNA methylation in human cancer. Genome Biol 2016;17:11.
- Saghafinia S , Mina M , Riggi N , Hanahan D , Ciriello G . Pan-cancer landscape of aberrant DNA methylation across human tumors. Cell Rep 2018;25:1066–80.
- Audia JE , Campbell RM . Histone modifications and cancer. Cold Spring Harb Perspect Biol 2016;8:a019521.
- Corces MR , Granja JM , Shams S , Louie BH , Seoane JA , Zhou W et al . The chromatin accessibility landscape of primary human cancers. Science 2018;362:eaav1898.
- Esteve-Puig R , Bueno-Costa A , Esteller M . Writers, readers and erasers of RNA modifications in cancer. Cancer Lett 2020;474:127–37.
- Janin M , Coll-SanMartin L , Esteller M . Disruption of the RNA modifications that target the ribosome translation machinery in human cancer. Mol Cancer 2020;19:70.
- Hanahan D , Coussens LM . Accessories to the crime: functions of cells recruited to the tumor microenvironment. Cancer Cell 2012;21:309–22.
- Lu Z , Zou J , Li S , Topper MJ , Tao Y , Zhang H et al . Epigenetic therapy inhibits metastases by disrupting premetastatic niches. Nature 2020;579:284–90.
- Thomas S , Izard J , Walsh E , Batich K , Chongsathidkiet P , Clarke G et al . The host microbiome regulates and maintains human health: a primer and perspective for non-microbiologists. Cancer Res 2017;77:1783–812.
- Dzutsev A , Badger JH , Perez-Chanona E , Roy S , Salcedo R , Smith CK et al . Microbes and cancer. Annu Rev Immunol 2017;35:199–228.
- Helmink BA , Khan MAW , Hermann A , Gopalakrishnan V , Wargo JA . The microbiome, cancer, and cancer therapy. Nat Med 2019;25:377–88.
- Sears CL , Garrett WS . Microbes, microbiota, and colon cancer. Cell Host Microbe 2014;15:317–28.
- Pleguezuelos-Manzano C , Puschhof J , Rosendahl Huber A , van Hoeck A , Wood HM , Nomburg J et al . Mutational signature in colorectal cancer caused by genotoxic pks+ E. coli. Nature 2020;580:269–73.
- Okumura S , Konishi Y , Narukawa M , Sugiura Y , Yoshimoto S , Arai Y et al . Gut bacteria identified in colorectal cancer patients promote tumourigenesis via butyrate secretion. Nat Commun 2021;12:5674.
- Salvi PS , Cowles RA . Butyrate and the intestinal epithelium: modulation of proliferation and inflammation in homeostasis and disease. Cells 2021;10:1775.
- Fessler J , Matson V , Gajewski TF . Exploring the emerging role of the microbiome in cancer immunotherapy. J Immunother Cancer 2019;7:108.
- Gopalakrishnan V , Helmink BA , Spencer CN , Reuben A , Wargo JA . The influence of the gut microbiome on cancer, immunity, and cancer immunotherapy. Cancer Cell 2018;33:570–80.
- Zitvogel L , Ma Y , Raoult D , Kroemer G , Gajewski TF . The microbiome in cancer immunotherapy: diagnostic tools and therapeutic strategies. Science 2018;359:1366–70.
- Baruch EN , Youngster I , Ben-Betzalel G , Ortenberg R , Lahat A , Katz L et al . Fecal microbiota transplant promotes response in immunotherapy-refractory melanoma patients. Science 2021;371:602–9.
- Davar D , Dzutsev AK , McCulloch JA , Rodrigues RR , Chauvin J-M , Morrison RM et al . Fecal microbiota transplant overcomes resistance to anti–PD-1 therapy in melanoma patients. Science 2021;371:595–602.
- Griffin ME , Espinosa J , Becker JL , Luo J-D , Carroll TS , Jha JK et al . Enterococcus peptidoglycan remodeling promotes checkpoint inhibitor cancer immunotherapy. Science 2021;373:1040–6.
- Mager LF , Burkhard R , Pett N , Cooke NCA , Brown K , Ramay H et al . Microbiome-derived inosine modulates response to checkpoint inhibitor immunotherapy. Science 2020;369:1481–9.
- Ansaldo E , Belkaid Y . How microbiota improve immunotherapy. Science 2021;373:966–7.
- Ansaldo E , Farley TK , Belkaid Y . Control of immunity by the microbiota. Annu Rev Immunol 2021;39:449–79.
- Zhang Q , Ma C , Duan Y , Heinrich B , Rosato U , Diggs LP et al . Gut microbiome directs hepatocytes to recruit MDSCs and promote cholangiocarcinoma. Cancer Discov 2021;11:1248–67.
- Ding T , Schloss PD . Dynamics and associations of microbial community types across the human body. Nature 2014;509:357–60.
- Byrd AL , Liu M , Fujimura KE , Lyalina S , Nagarkar DR , Charbit B et al . Gut microbiome stability and dynamics in healthy donors and patients with non-gastrointestinal cancers. J Exp Med 2021;218:e20200606.
- Healy CM , Moran GP . The microbiome and oral cancer: more questions than answers. Oral Oncol 2019;89:30-3.
- Swaney MH , Kalan LR . Living in your skin: microbes, molecules and mechanisms. Infect Immun 2021;89:e00695–20.
- Willis JR , Gabaldón T . The human oral microbiome in health and disease: from sequences to ecosystems. Microorganisms 2020;8:308.
- Xu J , Peng J-J , Yang W , Fu K , Zhang Y . Vaginal microbiomes and ovarian cancer: a review. Am J Cancer Res 2020;10:743–56.
- Nejman D , Livyatan I , Fuks G , Gavert N , Zwang Y , Geller LT et al . The human tumor microbiome is composed of tumor type-specific intracellular bacteria. Science 2020;368:973–80.
- Jin C , Lagoudas GK , Zhao C , Bullman S , Bhutkar A , Hu B et al . Commensal microbiota promote lung cancer development via γδ T cells. Cell 2019;176:998–1013.
- Pushalkar S , Hundeyin M , Daley D , Zambirinis CP , Kurz E , Mishra A et al . The pancreatic cancer microbiome promotes oncogenesis by induction of innate and adaptive immune suppression. Cancer Discov 2018;8:403–16.
- McAllister F , Khan MAW , Helmink B , Wargo JA . The tumor microbiome in pancreatic cancer: bacteria and beyond. Cancer Cell 2019;36:577–9.
- Kadosh E , Snir-Alkalay I , Venkatachalam A , May S , Lasry A , Elyada E et al . The gut microbiome switches mutant p53 from tumour-suppressive to oncogenic. Nature 2020;586:133–8.
- Birch J , Gil J . Senescence and the SASP: many therapeutic avenues. Genes Dev 2020;34:1565–76.
- Faget DV , Ren Q , Stewart SA . Unmasking senescence: context-dependent effects of SASP in cancer. Nat Rev Cancer 2019;19:439–53.
- Gorgoulis V , Adams PD , Alimonti A , Bennett DC , Bischof O , Bishop C et al . Cellular senescence: defining a path forward. Cell 2019;179:813–27.
- He S , Sharpless NE . Senescence in health and disease. Cell 2017;169:1000–11.
- Kowald A , Passos JF , Kirkwood TBL . On the evolution of cellular senescence. Aging Cell 2020;19:e13270.
- Lee S , Schmitt CA . The dynamic nature of senescence in cancer. Nat Cell Biol 2019;21:94–101.
- Wang B , Kohli J , Demaria M . Senescent cells in cancer therapy: friends or foes? Trends Cancer 2020;6:838–57.
- Baker DJ , Childs BG , Durik M , Wijers ME , Sieben CJ , Zhong J et al . Naturally occurring p16(Ink4a)-positive cells shorten healthy lifespan. Nature 2016;530:184–9.
- Ruhland MK , Loza AJ , Capietto A-H , Luo X , Knolhoff BL , Flanagan KC et al . Stromal senescence establishes an immunosuppressive microenvironment that drives tumorigenesis. Nat Commun 2016;7:11762.
- Hwang HJ , Lee Y-R , Kang D , Lee HC , Seo HR , Ryu J-K et al . Endothelial cells under therapy-induced senescence secrete CXCL11, which increases aggressiveness of breast cancer cells. Cancer Lett 2020;490:100–10.
- Wang D , Xiao F , Feng Z , Li M , Kong L , Huang L et al . Sunitinib facilitates metastatic breast cancer spreading by inducing endothelial cell senescence. Breast Cancer Res 2020;22:103.
- Amor C , Feucht J , Leibold J , Ho Y-J , Zhu C , Alonso-Curbelo D et al . Senolytic CAR T cells reverse senescence-associated pathologies. Nature 2020;583:127–32.
- Aster JC , Pear WS , Blacklow SC . The varied roles of notch in cancer. Annu Rev Pathol 2017;12:245–75.
- Kuczynski EA , Vermeulen PB , Pezzella F , Kerbel RS , Reynolds AR . Vessel co-option in cancer. Nat Rev Clin Oncol 2019;16:469–93.
Google ScholarCrossref

 Suche
Suche
 Mein Konto
Mein Konto
