Syövän ominaisuudet: uudet ulottuvuudet
Esipuhe The Hallmarks of Cancer Conceptualization on heuristinen työkalu syövän fenotyyppien ja genotyyppien valtavan monimutkaisuuden tislaamiseksi alustavaksi joukoksi taustalla olevia periaatteita. Kun tieto syövän mekanismeista on edennyt, taudin muut puolet ovat tulleet esiin mahdollisina parannuksina. Tämä herättää mahdollisuuden, että fenotyyppinen plastisuus ja epäsäännöllinen erilaistuminen ovat erillinen ominaisuuskyky ja että ei-mutaatiollinen epigeneettinen uudelleenohjelmointi ja polymorfiset mikrobiomit edustavat molemmat ominaisia mahdollistavia ominaisuuksia, jotka helpottavat tyypillisten kykyjen hankkimista. Lisäksi eri alkuperää olevia vanhenevia soluja voidaan lisätä toiminnallisesti tärkeiden solutyyppien luetteloon kasvaimen mikroympäristössä. Se tarkoittaa, että syöpä on pelottava...

Syövän ominaisuudet: uudet ulottuvuudet
Esipuhe
The Hallmarks of Cancer Conceptualization on heuristinen työkalu syövän fenotyyppien ja genotyyppien valtavan monimutkaisuuden tislaamiseksi alustavaksi joukoksi taustalla olevia periaatteita. Kun tieto syövän mekanismeista on edennyt, taudin muut puolet ovat tulleet esiin mahdollisina parannuksina. Tämä herättää mahdollisuuden, että fenotyyppinen plastisuus ja epäsäännöllinen erilaistuminen ovat erillinen ominaisuuskyky ja että ei-mutaatiollinen epigeneettinen uudelleenohjelmointi ja polymorfiset mikrobiomit edustavat molemmat ominaisia mahdollistavia ominaisuuksia, jotka helpottavat tyypillisten kykyjen hankkimista. Lisäksi eri alkuperää olevia vanhenevia soluja voidaan lisätä toiminnallisesti tärkeiden solutyyppien luetteloon kasvaimen mikroympäristössä.
Merkitys
Syöpä on pelottava sen monimuotoisuuden laajuudessa ja laajuudessa, joka sisältää genetiikan, solu- ja kudosbiologian, patologian ja vasteen hoitoon. Yhä tehokkaammat kokeelliset ja laskennalliset työkalut ja tekniikat tarjoavat lumivyöryn "suuria tietoja" syövän sisältämistä lukemattomista sairauksien ilmenemismuodoista. Syövän tunnusmerkkeihin sisältyvä integroiva konsepti auttaa tislaamaan tämän monimutkaisuuden yhä loogisemmaksi tieteeksi, ja tässä näkökulmassa esitetyt alustavat uudet ulottuvuudet voivat tuoda lisäarvoa tälle pyrkimykselle ymmärtää paremmin karsinogeneesin ja pahanlaatuisen etenemisen mekanismeja ja soveltaa tätä tietoa syöpälääketieteessä.
esittely
Syövän tunnusmerkkejä on ehdotettu joukkona toiminnallisia ominaisuuksia, jotka ihmissolut hankkivat siirtyessään normaalista kasvainkasvutilaan, tarkemmin sanottuna kyvyiksi, jotka ovat kriittisiä niiden kyvylle muodostaa pahanlaatuisia kasvaimia. Näissä artikkeleissa ( 1, 2 ), Bob Weinberg ja minä listasimme sen, mitä kuvittelimme yhteisiksi piirteiksi, jotka yhdistävät kaikentyyppiset syöpäsolut solufenotyypin tasolla. Tarkoituksena oli tarjota käsitteellinen kehys, joka mahdollistaisi erilaisten ihmisen kasvaintyyppien ja -varianttien monimutkaisten fenotyyppien järkeistämisen suhteessa yhteiseen taustalla olevien soluparametrien joukkoon. Aluksi visioimme kuuden eri brändin täydentävän sisällyttämisen, ja myöhemmin laajensimme tämän määrän kahdeksaan.
Tähän formulaatioon vaikutti se oivallus, että ihmisen syövät kehittyvät monivaiheisten prosessien tuotteina ja että näiden toiminnallisten kykyjen hankkiminen voidaan jollain tavalla katsoa johtuvan kasvaimen patogeneesin eri vaiheista. Pahanlaatuisen patogeneesin monimuotoisuus, joka käsittää useita kasvaintyyppejä ja kasvavan joukon alatyyppejä, sisältää erilaisia poikkeavuuksia (ja siten hankittuja kykyjä ja ominaisuuksia), jotka ovat seurausta kudosspesifisistä esteistä, jotka väistämättä ohitetaan tiettyjen tuumorigeneesireittien aikana. Vaikka ymmärrämme, että tällaiset erikoistuneet mekanismit voivat olla hyödyllisiä, olemme rajoittaneet tunnusmerkkien määrittämisen parametreihin, joilla on laaja vaikutus ihmisten syöpien kirjossa.
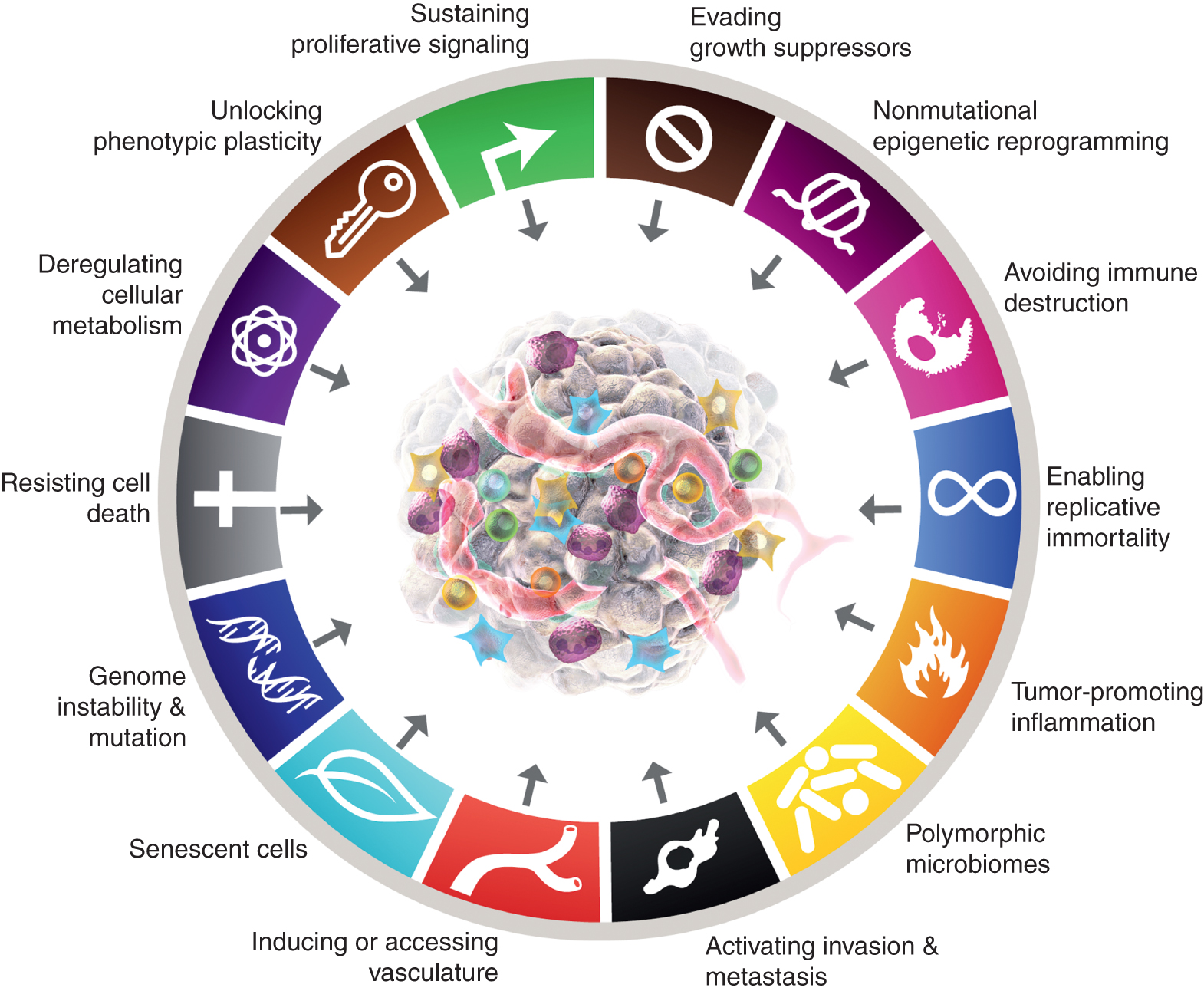
Tällä hetkellä kahdeksan tunnusmerkkiä sisältävät (kuva 1, vasemmalla) hankitut kyvyt ylläpitää proliferatiivista signalointia, välttää kasvun suppressoreita, vastustaa solukuolemaa, mahdollistaa replikaatiivinen kuolemattomuus, indusoida/pääsy suoniin, aktivoida invaasiota ja metastasoitumista, ohjelmoida uudelleen solujen aineenvaihduntaa ja välttää immuunijärjestelmän tuhoutuminen. Tämän käsitteen viimeisimmässä kehittelyssä (2) solujen aineenvaihdunnan purkaminen ja immuunijärjestelmän tuhoutumisen välttäminen rajattiin "nouseviin tunnusmerkkeihin", mutta nyt, yksitoista vuotta myöhemmin, on ilmeistä, että alkuperäisen kuuden tapaan niitä voidaan pitää syövän keskeisinä tunnusmerkeinä ja ne sisältyvät sellaisinaan nykyiseen selostukseen (kuva 1, vasemmalla).
Kuva 1
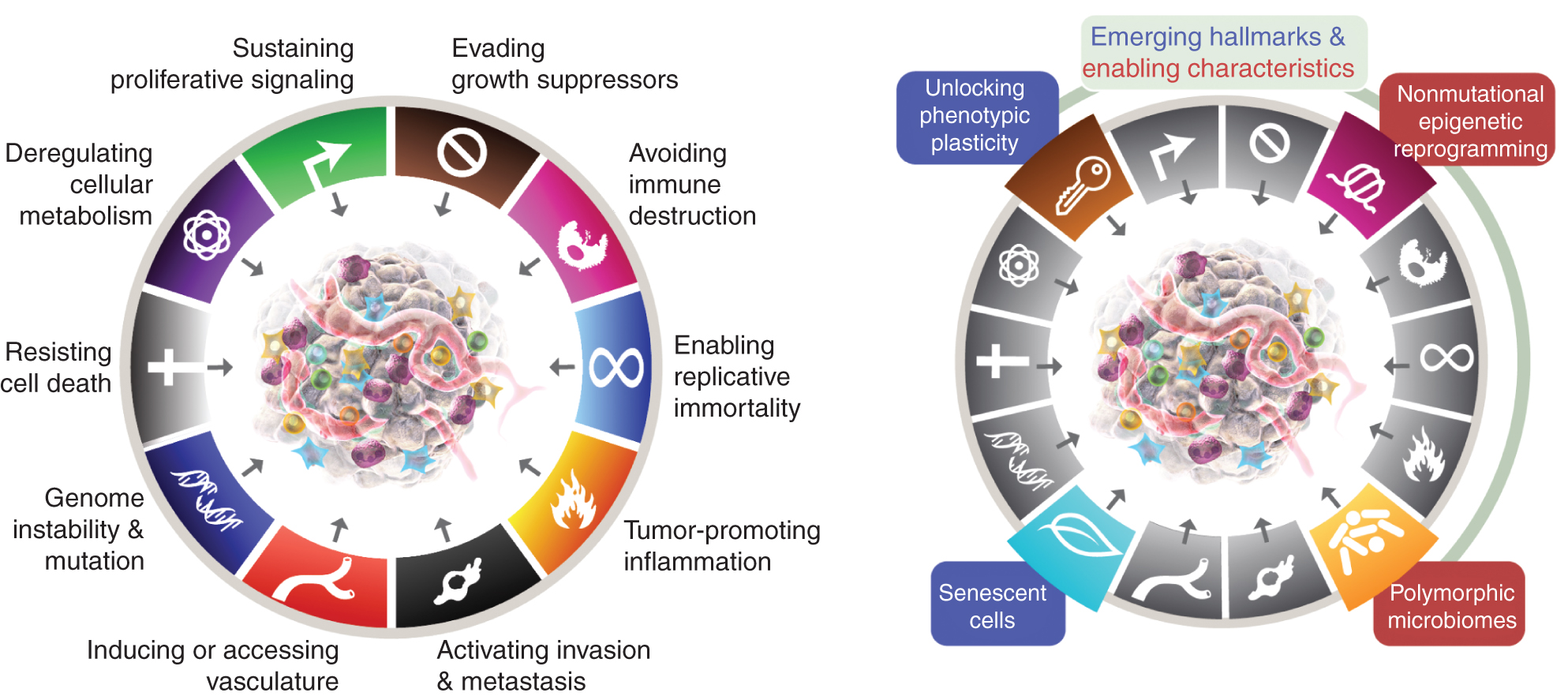
Syövän tunnusmerkit ilmentävät tällä hetkellä kahdeksan erilaista kykyä ja kaksi tukevaa ominaisuutta. Kuuden hankitun ominaisuuden - syövän tunnusmerkit - ehdotettiin vuonna 2000 (1) lisäksi kaksi alustavaa "nousevaa tunnusmerkkiä", jotka esiteltiin vuonna 2011 (2) - soluenergetiikka (jota kutsutaan nykyään yleisemmin "solujen aineenvaihdunnan uudelleenohjelmoimiseksi") ja "immuunijärjestelmän tuhoutumisen välttäminen" - on katsottu riittävän vahvistetuiksi osaksi ydintä.
Ottaen huomioon kasvava tunnustus, että kasvaimia voidaan verisuonoida riittävästi joko kytkemällä päälle angiogeneesi tai käyttämällä normaalia kudossuonirakennetta (128), tämä tunnusmerkki määritellään myös laajemmin kyvyksi indusoida tai muuten päästä käsiksi tuumorin kasvua tukevaan verisuoniin ensisijaisesti invaasion ja etäpesäkkeiden kautta.
Vuoden 2011 jatko-osa sisälsi myös "kasvainta edistävän tulehduksen" toisena mahdollistavana ominaisuutena, joka täydensi yleistä "genomin epävakautta ja mutaatiota", jotka yhdessä olivat olennaisesti osallisena tuumorin kasvun ja etenemisen edellyttämien kahdeksan tunnusomaisen (toiminnallisen) ominaisuuden aktivoimisessa. Totta, tämä katsaus sisältää uusia ehdotettuja uusia tunnusmerkkejä ja mahdollistavia ominaisuuksia, mukaan lukien "fenotyyppisen plastisuuden avaaminen", "ei-mutaatiollinen epigeneettinen uudelleenohjelmointi", "polymorfiset mikrobiomit" ja "vanhenevat solut". Syöpägrafiikan tavaramerkit otettiin käyttöön Hanahanilta ja Weinbergiltä (2).
Kuten tuolloin totesimme, nämä erityispiirteet eivät yksinään voi käsitellä syövän patogeneesin monimutkaisuutta, eli h. tarkat molekyyli- ja solumekanismit, jotka mahdollistavat kehittyvien preneoplastisten solujen kehittymisen ja näiden poikkeavien fenotyyppisten kykyjen hankkimisen tuumorigeneesin ja pahanlaatuisen etenemisen aikana.
Näin ollen olemme lisänneet keskusteluun toisen käsitteen, joka esitetään "mahdollisuuksina", kasvaimen poikkeavan tilan seurauksina, jotka tarjoavat keinot, joilla syöpäsolut ja kasvaimet voivat hankkia nämä toiminnalliset piirteet. Sellaisenaan mahdollistavat ominaisuudet heijastuvat molekyyli- ja solumekanismeihin, joiden kautta tunnusmerkit hankitaan, eivätkä yllä oleviin kahdeksaan taitoon itsessään. Nämä kaksi aktivaatioprosessia olivat genomin epävakaus ja kasvainta edistävä tulehdus.
Huomasimme lisäksi, että tuumorimikroympäristö (TME), joka tässä määritellään koostuvan heterogeenisistä ja vuorovaikutteisista syöpäsolujen ja syövän kantasolujen populaatioista sekä useista rekrytoiduista stroomasolutyypeistä - transformoituneen parenkyymin ja siihen liittyvän strooman - katsotaan nyt olevan olennainen rooli tuumorin muodostumisessa ja pahanlaatuisen etenemisessä.
Kun otetaan huomioon jatkuva kiinnostus näitä muotoiluja kohtaan ja jatkuva aikomuksemme kannustaa jatkuvaa keskustelua ja hienostuneisuutta Hallmarks-skeemasta, on aiheellista pohtia usein kysyttyä kysymystä: Onko tässä käsitteellisessä mallissa muita ominaisuuksia, joita voitaisiin sisällyttää, kun otetaan huomioon tarve varmistaa tämä? että ne soveltuvat laajasti ihmisten syöpien kirjolle? Näin ollen esitän useita mahdollisia uusia tunnusmerkkejä ja mahdollistavia ominaisuuksia, jotka voitaisiin aikanaan integroida syövän käsitteellistämisen tunnusmerkkien ydinkomponentteiksi.
Nämä parametrit ovat "fenotyyppisen plastisuuden avaaminen", "ei-mutaatiollinen epigeneettinen uudelleenohjelmointi", "polymorfiset mikrobiomit" ja "vanhenevat solut" (Kuva 1, oikealla). Tärkeää on, että näiden teesien tueksi esitetyt esimerkit ovat havainnollistavia, mutta eivät suinkaan kattavia, koska jokaista vinjettiä tukee kasvava ja yhä vakuuttavampi joukko julkaistuja todisteita.
Fenotyyppisen plastisuuden napauttaminen
Organogeneesin aikana solujen kehittymiseen, määrittämiseen ja organisoitumiseen kudoksiksi homeostaattisten toimintojen suorittamiseksi liittyy terminaalinen erilaistuminen, jolloin esisolut lakkaavat kasvamasta, joskus peruuttamattomasti, kun nämä prosessit kulminoituvat. Sellaisenaan solujen erilaistumisen lopputulos on useimmissa tapauksissa antiproliferatiivinen, mikä muodostaa selvän esteen neoplasian välttämättömälle jatkuvalle lisääntymiselle.
On yhä enemmän todisteita siitä, että fenotyyppisen plastisuuden normaalisti rajoitetun kapasiteetin vapauttaminen terminaalisen erilaistumisen tilan kiertämiseksi tai siitä pakoon on syövän patogeneesin kriittinen osa (3). Tämä plastisuus voi toimia useissa ilmenemismuodoissa (kuva 2). Siten syntymässä olevat syöpäsolut, jotka ovat peräisin normaalista solusta, joka on kehittynyt polkua pitkin, joka lähestyy tai omaksuu täysin erilaistuneen tilan, voi kääntää kurssin dedifferentioimalla takaisin progenitorin kaltaisiin solutiloihin.
Sitä vastoin neoplastiset solut, jotka syntyvät progenitorisolusta, jonka on määrä seurata terminaaliseen erilaistumiseen johtavaa reittiä, voivat oikosulkea prosessin ja ylläpitää laajenevat syöpäsolut osittain erilaistuneessa, progenitorimaisessa tilassa. Vaihtoehtoisesti voi tapahtua transdifferentiaatiota, jossa solut, jotka alun perin sitoutuivat yhteen erilaistumisreittiin, siirtyvät täysin eri kehitysohjelmaan ja saavat siten kudosspesifisiä ominaisuuksia, joita niiden normaalit alkuperäsolut eivät ole ennalta määrittäneet.
Seuraavat esimerkit tukevat väitettä, jonka mukaan soluplastisuuden eri muodot paljastavat fenotyyppisen plastisuuden. Vasemmalla fenotyyppinen plastisuus on luultavasti hankittu ominaisuus, joka mahdollistaa solujen erilaistumisen erilaiset häiriöt, mukaan lukien (i) erilaistuminen kypsistä progenitoritiloista, (ii) pysähtynyt (terminaalinen) erilaistuminen progenitorisolutiloista ja (iii) transdifferentioituminen muihin solulinjoihin. Oikealla on kolme näkyvää heikentyneen erilaistumisen muotoa, jotka ovat olennaisia syövän patogeneesissä.
Perversoimalla differentiaalisesti progenitorisolujen normaali erilaistuminen kypsiksi soluiksi kehityslinjoissa, tuumorigeneesiä ja pahanlaatuista etenemistä, joka johtuu alkuperäsoluista tällaisissa reiteissä, helpotetaan. Syöpägrafiikan tavaramerkit otettiin käyttöön Hanahanilta ja Weinbergiltä (2).
Kuva 2

Erilaistuminen
Paksusuolen karsinogeneesi on esimerkki heikentyneestä erilaistumisesta, koska alkavilla syöpäsoluilla on teleologinen tarve paeta terminaalisen erilaistumisen ja hilseilyn liukuhihnalta, mikä voisi periaatteessa tapahtua sellaisten paksusuolen epiteelisolujen erilaistumisesta, jotka eivät ole vielä lopullisesti erilaistuneet, tai näiden erilaisten kantasolujen esi-/kantasolujen erilaistumisen pysähtyessä. Sekä erilaistuneiden solujen että kantasolujen on katsottu olevan paksusuolensyövän alkuperäsoluja (4-6).
Kaksi kehityksen transkriptiotekijää (TF), homeobox-proteiini HOXA5 ja SMAD4, joista jälkimmäinen osallistuu BMP-signalointiin, ekspressoituvat voimakkaasti erilaistuvissa paksusuolen epiteelisoluissa, ja ne tyypillisesti menetetään pitkälle edenneissä paksusuolen karsinoomissa, jotka ilmentävät tyypillisesti kanta- ja esisolujen markkereita. Toiminnalliset häiriöt hiirimalleissa ovat osoittaneet, että HOXA5:n pakotettu ilmentyminen paksusuolen syöpäsoluissa palauttaa erilaistumismarkkereita, suppressoi kantasolujen fenotyyppejä ja heikentää tunkeutumista ja metastasoitumista, mikä antaa syyn sen ominaiselle alasäätelylle (7, 8).
Sitä vastoin SMAD4 pakottaa sekä onkogeenisen WNT-signaloinnin aiheuttaman proliferaation erilaistumiseen että tukahduttamiseen, mikä paljastuu SMAD4:n ilmentymisen muokattuna häviämisenä, mikä selittää sen ilmentymisen häviämisen mahdollistaen erilaistumisen ja myöhemmin WNT:n aiheuttaman hyperproliferaation (5).
Erityisesti näiden kahden "erilaistumisen vaimentajan" menettäminen ja tuloksena oleva erilaistuminen liittyvät muiden tunnusmerkkikykyjen sekä muiden leimamerkkiä indusoivien säätimien hankkimiseen, mikä vaikeuttaa tämän väliaikaisen tunnusmerkin tiukkaa määrittelyä erotettavaksi ja riippumattomaksi.
Toinen todisteiden linja koskee melanosyyttien erilaistumisen pääsäätelijän MITF:n vaimentunutta ilmentymistä, joka näyttää olevan osallisena pahanlaatuisen melanooman aggressiivisten muotojen synnyssä. Tämän kehitysvaiheen TF:n menettäminen liittyy hermoharjan progenitorigeenien uudelleenaktivoitumiseen ja täysin erilaistuneille melanosyyteille luonnehtivien geenien heikkenemiseen. Hermosolujen geenien uudelleenilmentyminen osoittaa, että nämä solut palaavat progenitoritilaan, josta melanosyytit kehittyvät.
Lisäksi BRAF-indusoitujen melanoomien sukulinjan jäljitystutkimuksessa todettiin kypsät pigmentoidut melanosyytit alkuperäsoluiksi, jotka käyvät läpi erilaistumisen tuumorigeneesin aikana (9). Erityisesti mutantti BRAF-onkogeeni, jota löytyy yli puolessa ihomelanoomista, indusoi hyperproliferaatiota, joka edeltää ja voidaan siksi erottaa mekaanisesti siitä seuraavasta dedifferentioitumisesta, joka johtuu MITF:n heikentymisestä.
Toinen tutkimus liittyi toiminnallisesti kehittyvän TF ATF2:n lisääntymiseen, jonka tyypillinen ilmentyminen hiiren ja ihmisen melanoomissa suppressoi epäsuorasti MITF1:tä, mikä liittyy pahanlaatuiseen etenemiseen näin ollen erilaistuneissa melanoomasoluissa (10). Sitä vastoin ATF2:n mutanttimuotojen, jotka eivät pysty tukahduttamaan MITF:ää, ilmentyminen melanoomissa johtaa hyvin erilaistuneisiin melanoomeihin (11).
Lisäksi äskettäinen tutkimus (12) on yhdistänyt linjan erilaistumisen haiman saarekesolukasvaimien pahanlaatuiseen etenemiseen metastaaseille alttiisiin karsinoomiin; nämä neuroendokriiniset solut ja niistä johdetut kasvaimet syntyvät kehityslinjasta, joka eroaa siitä, joka synnyttää paljon suuremman määrän vierekkäisiä soluja, jotka muodostavat eksokriinisen ja haiman ja tuloksena olevat duktaaliset adenokarsinoomat.
On huomattava, että monivaiheinen erilaistumisreitti saarekesoluista kypsiin β-soluihin on karakterisoitu perusteellisesti (13). Vertaileva transkriptioprofiili osoittaa, että adenooman kaltaiset saarekekasvaimet ovat eniten samankaltaisia kuin kypsymättömät, mutta erilaistuneet insuliinia tuottavat β-solut, kun taas invasiiviset karsinoomat ovat eniten samankaltaisia kuin alkion saarekesolujen esiasteet. Eteneminen huonosti erilaistuneiksi karsinoomiksi sisältää erilaistumisen alkuvaiheen, johon ei aluksi liity lisääntynyttä proliferaatiota tai vähentynyttä apoptoosia verrattuna hyvin erilaistuneisiin adenoomeihin, joilla molemmilla on taipumus ilmaantua myöhemmin.
Siten erillistä erilaistumisvaihetta eivät ohjaa havaittavat muutokset jatkuvan proliferaation ja apoptoosin vastustuskyvyn ominaispiirteissä. Pikemminkin miRNA:n ylössäätely, joka oli aiemmin osallisena saarekeen progenitoritilan määrittämisessä, on sellainen, joka on alasäädelty β-solujen terminaalisen erilaistumisen aikana, 12).
Estetty erottelu
Vaikka yllä olevat esimerkit havainnollistavat, kuinka erilaistumistekijän ilmentymisen suppressio voi helpottaa tuumorigeneesiä sallimalla paremmin erilaistuneiden solujen erilaistuminen esisoluiksi, muissa tapauksissa epätäydellisesti erilaistuneet progenitorisolut voivat kärsiä säätelymuutoksista, jotka estävät aktiivisesti niiden etenemisen täysin erilaistuneisiin, tyypillisesti ei-proliferatiivisiin tiloihin.
Pitkään on dokumentoitu, että akuutti promyelosyyttinen leukemia (APL) johtuu kromosomaalisesta translokaatiosta, joka fuusioi PML-lokuksen geeniin, joka koodaa retinoiinihapon a-tumareseptoria (RARa). Sellaisia translokaatioita kantavat myeloidiset progenitorisolut eivät ilmeisesti pysty jatkamaan tavallista terminaalista erilaistumistaan granulosyyteiksi, mikä johtaa soluihin, jotka jäävät loukkuun proliferatiiviseen, promyelosyyttien kaltaiseen progenitorivaiheeseen (14).
Todiste tämän järjestelmän konseptista tulee viljeltyjen APL-solujen, taudin hiirimallien ja sairastuneiden potilaiden hoidosta retinoiinihapolla, RARa:n ligandilla; Tämä terapeuttinen hoito saa neoplastiset APL-solut erilaistumaan näennäisesti kypsiksi, proliferoimattomiksi granulosyyteiksi, mikä oikosulkee niiden progressiivisen proliferatiivisen laajentumisen (14–16).
Tämän teeman muunnelma koskee toista akuutin myelooisen leukemian muotoa, jossa on t(8;21)-translokaatio, joka tuottaa AML1-ETO-fuusioproteiinia. Tämä proteiini yksinään voi muuttaa myelooisia progenitoreja, ainakin osittain estämällä niiden erilaistumisen. Terapeuttinen interventio hiirimalleissa ja potilaissa, joilla on kromatiinia modifioivan histonideasetylaasin (HDAC) farmakologinen inhibiittori, saa myelooisen leukemiasolut jatkamaan erilaistumista soluiksi, joilla on kypsempi myeloidisolumorfologia. Tähän reaktioon liittyy proliferatiivisen kapasiteetin väheneminen, mikä heikentää tämän leukemian etenemistä (17, 18).
Kolmas esimerkki melanoomasta sisältää kehitysvaiheen TF:n, SOX10:n, joka normaalisti vähenee melanosyyttien erilaistumisen aikana. Toiminnan vahvistuminen ja menetys BRAF-indusoitujen melanoomien seeprakalamallissa ovat osoittaneet, että SOX10:n epänormaalisti ylläpidetty ilmentyminen estää hermosolujen esisolujen erilaistumisen melanosyyteiksi, mikä mahdollistaa BRAF-peräisten melanoomien muodostumisen (19).
Muita esimerkkejä erilaistumisen modulaattoreista ovat metaboliitti alfa-ketoglutaraatti (αKG), välttämätön kofaktori useille kromatiinia modifioiville entsyymeille, joiden on osoitettu osallistuvan tiettyjen erilaistuneiden solutilojen stimulaatioon. Haimasyövässä tuumorisuppressori p53 stimuloi αKG:n tuotantoa ja erilaistuneemman solutilan ylläpitoa, kun taas p53:n toiminnan prototyyppinen menetys johtaa αKG-tasojen laskuun ja sen seurauksena erilaistumiseen, mikä liittyy pahanlaatuiseen etenemiseen (20).
Yhdessä maksasyövän muodossa isositraattidehydrogenaasigeenin (IDH1/2) mutaatio ei johda erilaistumista indusoivan αKG:n tuotantoon, vaan pikemminkin siihen liittyvään "onkometaboliittiin", D-2-hydroksigluteraattiin (D2HG), jonka on osoitettu estävän maksasolujen erilaistumista maksan kantasolujen GG-välitteisen repression kautta D2H:n kautta. erilaistuminen ja hiljaisuus, HNF4a.
D2HG-välitteinen HNF4a-toiminnan suppressio laukaisee maksassa olevien hepatosyyttien progenitorisolujen proliferatiivisen laajentumisen, jotka tulevat alttiiksi onkogeeniselle transformaatiolle KRAS-onkogeenin myöhemmän mutaatioaktivaation seurauksena, mikä johtaa pahanlaatuiseen etenemiseen maksan kolangiokarsinoomaan (21). IDH1/2-mutantti ja sen onkometaboliitti D2HG toimivat myös useissa myeloidisissa ja muissa kiinteissä kasvaintyypeissä, joissa D2HG estää αKG-riippuvaisia dioksigenaaseja, joita tarvitaan histonien ja DNA:n metylaatiotapahtumiin, jotka välittävät kromatiinin rakenteen muutoksia kehityslinjan erilaistumisen aikana, jäädyttäen siten syöpäsolujen syntymisen (2, progenitori 2 -solut).
Toinen asiaan liittyvä käsite on ohitettu erilaistuminen, jossa osittain tai erilaistumattomat esi-/kantasolut poistuvat solusyklistä ja ovat lepotilassa suojarakoissa, jolloin ne voivat käynnistää uudelleen proliferatiivisen laajenemisen (24), vaikka niillä on edelleen selektiivinen paine häiritä ohjelmoitua erilaistumistaan tavalla tai toisella.
Transdifferentioituminen
Patologit ovat pitkään tunnustaneet transdifferentioitumisen käsitteen kudosmetaplasian muodossa, jossa tietyn erilaistuneen fenotyypin solut muuttavat merkittävästi morfologiaansa tullakseen selvästi tunnistettavissa oleviksi toisen kudoksen elementeiksi, joista näkyvä esimerkki on Barrettin ruokatorvi, jossa kerrostetun levyepiteelin krooninen tulehdus induktii esodiphagusin yksinkertaisen epiteelin suolistossa, mikä helpottaa adenokarsinoomien myöhempää kehittymistä pikemminkin kuin tästä levyepiteelistä odotettavissa olevien levyepiteelien kehittymistä (3).
Nyt molekyylideterminantit paljastavat transdifferentioitumismekanismeja eri syövissä sekä tapauksissa, joissa kudosten karkea metaplasia on ilmeinen, että muissa tapauksissa, joissa se on hieman hienovaraisempi, kuten seuraavat esimerkit osoittavat.
Informatiivinen tapaus transdifferentioitumiselle tuumorigeneesin erillisenä tapahtumana koskee haiman ductal adenokarsinoomaa (PDAC), jossa yksi mukana olevista alkuperäsoluista, haiman akinaarisolu, voi transdifferentioitua duktaalisolujen fenotyypiksi neoplastisen kehityksen alkaessa. Kaksi TF:tä – PTF1a ja MIST1 – säätelevät haiman erilaistuneiden akinaarisolujen tilan määrittelyä ja ylläpitoa niiden ilmentymisen kautta itseään ylläpitävien "eteenpäin syöttävien" säätelysilmukoiden yhteydessä (25).
Molemmat näistä TF:istä säätelevät usein alas neoplastisen kehityksen ja ihmisen ja hiiren PDAC:n pahanlaatuisen etenemisen aikana. Funktionaaliset geneettiset tutkimukset hiirillä ja viljellyillä ihmisen PDAC-soluilla ovat osoittaneet, että PTF1a:n kokeellinen pakotettu ilmentyminen heikentää KRAS-indusoitua transdifferentiaatiota ja proliferaatiota ja voi myös pakottaa jo kasvainsolujen uudelleenerilaistumisen lepotilaan akinaarisolufenotyyppiin (26).
Sitä vastoin PTF1a:n ilmentymisen suppressio laukaisee akinaarista kanavaan metaplasiaa, nimittäin transdifferentiaatiota, ja siten herkistää kanavan kaltaiset solut onkogeeniselle KRAS-transformaatiolle, mikä nopeuttaa myöhempää invasiivisen PDAC:n kehittymistä (27). Samoin MIST1:n pakotettu ilmentyminen KRAS-proteiinia ekspressoivassa haimassa estää myös transdifferentioitumisen ja heikentää haiman tuumorigeneesin alkamista, mitä muutoin helpottaa premalignin kanavan kaltaisten (PanIN) leesioiden muodostuminen, kun taas MIST1:n geneettinen deleetio tehostaa niiden muodostumista ja 28-plastisen neoplastisen vaikutuksen alkamista.
Joko PTF1:n tai MIST1:n ilmentymisen menetys tuumorigeneesin aikana liittyy toisen kehitystä säätelevän TF:n, SOX9:n, lisääntyneeseen ekspressioon, joka on normaalisti tehokas duktaalisolujen määrittelyssä (27, 28). SOX9:n pakotetun ylössäätelyn, jolloin vältetään PTF1a:n ja MIST1:n alasäätelyn tarve, ja MIST1:n on myös osoitettu stimuloivan akinaarisolujen transdifferentioitumista KRAS-indusoidulle neoplasialle herkäksi duktaalisolufenotyypiksi (29), mikä viittaa siihen, että SOX9 on keskeinen toiminnallinen vaikuttaja niiden ihmisen PDAC-säätelyssä geeneissä.
Siten kolmea haiman erilaistumista säätelevää TF:ää voidaan muuttaa eri tavoilla transdifferentioituneen tilan indusoimiseksi, joka KRAS:n mutaatioaktivaation yhteydessä helpottaa onkogeenista transformaatiota ja tuumorigeneesin ja pahanlaatuisen etenemisen alkamista.
Kromatiiniin liittyvien säätelytekijöiden SOX-perheen muut jäsenet liittyvät toisaalta suurelta osin sekä solujen kohtalon spesifikaatioon että sukulinjan vaihtamiseen kehityksessä (30) ja toisaalta useisiin kasvaimeen liittyviin fenotyyppeihin (31). Toinen näkyvä esimerkki SOX-välitteisestä transdifferentiaatiosta sisältää terapeuttisen resistenssin mekanismin eturauhassyövässä.
Tässä tapauksessa RB- ja p53-kasvainsuppressorien - joiden puuttuminen on tyypillistä neuroendokriinisille kasvaimille - menetys vasteena antiandrogeenihoitoon on välttämätöntä, mutta ei riittävää hyvin erilaistuneiden eturauhassyöpäsolujen yleisesti havaittuun transformaatioon karsinoomasoluiksi, jotka ovat tunkeutuneet erilaistumislinjaan molekyyli- ja histologisilla ominaisuuksilla, jotka eivät ilmennä neuroendokriinisten reseptoreiden soluja. RB:n ja p53:n häviämisen lisäksi hankittu resistenssi antiandrogeenihoidolle vaatii SOX2:n, kehitystä säätelevän geenin, lisääntynyttä ilmentymistä, jonka on osoitettu auttavan indusoimaan hoitoon reagoivien adenokarsinoomasolujen transdifferentioitumista johdannaisiksi, jotka ovat neuroendokriinisessa solutilassa, joka ei kestä hoitoa (32).
Kolmas esimerkki osoittaa myös transdifferentioitumisen strategiana, jota karsinoomasolut käyttävät välttääkseen eliminaatiota sukulinjaspesifisellä hoidolla, tässä tapauksessa ihon tyvisolukarsinoomien (BCC) kanssa, joka on hoidettu Hedgehog-Smoothened (HH/SMO) -onkogeenisen reitin farmakologisella inhibiittorilla, jonka tiedetään ohjaavan näiden solujen neoplastista kasvua (33).
Lääkeresistentit syöpäsolut siirtyvät kehitykseen liittyvään, mutta erilliseen solutyyppiin spesifisten kromatiinidomeenien laajojen epigeneettisten muutosten ja kahden supertehostimen muuttuneen saatavuuden kautta. Hiljattain hankittu BCC-solujen fenotyyppinen tila antaa niille mahdollisuuden ylläpitää onkogeenisen WNT-signalointireitin ilmentymistä, mikä puolestaan antaa riippumattomuuden lääkkeen tukahduttamasta HH/SMO-signalointireitistä (34).
Kuten tästä transdifferentioitumisesta odotettiin, syöpäsolujen transkripti siirtyy geenikirjoituksesta, joka heijastaa mukana olevaa BCC:iden alkuperäsolua, nimittäin karvatupen pullistuneita kantasoluja, allekirjoitukseen, joka osoittaa BCC:n follikulaarisen epidermiksen kantasoluja. Tällaista transdifferentiaatiota lääkeresistenssin mahdollistamiseksi dokumentoidaan yhä useammin erilaisissa syövän muodoissa (35).
Kehityslinjan plastisuus näyttää myös olevan vallitseva keuhkokarsinooman pääalatyypeissä, eli h. neuroendokriinisissa karsinoomissa [pienisoluinen keuhkosyöpä (SCLC)] ja adenokarsinoomat + levyepiteelisyöpä [kollektiivinen ei-pienisoluinen keuhkosyöpä (NSCLC)]. Yksisoluinen RNA-sekvensointi on paljastanut huomattavan dynaamisen ja heterogeenisen muuntumisen näiden alatyyppien välillä sekä merkittäviä variaatioita niissä keuhkojen kasvainten muodostumisen, myöhemmän pahanlaatuisen etenemisen ja hoitovasteen aikana (36-38).
Siksi puhtaan kloonaalisen siirtymisen yhdestä sukulinjasta toiseen yksinkertaisen käsitteellisen käsitteen sijaan nämä tutkimukset antavat paljon monimutkaisemman kuvan dynaamisesti muuntuvista syöpäsolujen alapopulaatioista, joissa on useita kehityslinjoja ja erilaistumisvaiheita, mikä on raitistava oivallus tässä suhteessa ihmisen keuhkosyövän linjaperustaiseen terapeuttiseen kohdentamiseen. Tämän dynaamisen fenotyyppisen plastisuuden säätelytekijöitä aletaan tunnistaa (37, 39, 40).
Yhteenveto
Yllä kuvatut kolme mekanismiluokkaa korostavat selektiivisiä soluplastisuuden säätelijöitä, jotka ovat – ainakin osittain – erotettavissa ydinonkogeenisista tekijöistä ja muista erottuvista ominaisuuksista. Näiden esimerkkien lisäksi on olemassa merkittävä joukko todisteita, jotka yhdistävät monet syövän muodot heikentyneeseen erilaistumiseen, johon liittyy transkription allekirjoitusten ja muiden fenotyyppien hankkiminen - esimerkiksi histologinen morfologia -, jotka liittyvät vastaavissa normaaleissa kudoksissa havaittuihin progenitori- tai kantasoluvaiheisiin. alkuperästä tai muista kauempaa sukulaisista solutyypeistä ja -linjoista (41-43).
Sellaisenaan nämä fenotyyppisen plastisuuden kolme alaluokkaa – kypsien solujen erilaistuminen takaisin kantasolutiloihin, pysähtynyt erilaistumisen kehittyvien solujen jäädyttämiseksi progenitori-/kantasolutiloissa ja transdifferentioituminen vaihtoehtoisiin solulinjoihin – näyttävät olevan tehokkaita useissa syöpätyypeissä primaarisen kasvaimen muodostumisen, pahanlaatuisen vasteen hoitoon ja/tai aikana.
On kuitenkin olemassa kaksi käsitteellistä näkökohtaa. Ensinnäkin erilaistuminen ja pysähtynyt erilaistuminen kietoutuvat todennäköisesti toisiinsa, koska niitä ei voida erottaa monissa kasvaintyypeissä, joissa alkuperäsolu - erilaistunut solu tai progenitori/kantasolu - on joko tuntematon tai vaihtoehtoisesti mukana. Toiseksi progenitorisolufenotyyppien hankkiminen tai ylläpito ja erilaistuneiden ominaisuuksien menettäminen on useimmissa tapauksissa epätarkka heijastus normaalista kehitysvaiheesta, uppoaen syöpäsolun muiden tunnusomaisten muutosten miljööseen, joita ei esiinny luonnollisesti kehittyvissä soluissa.
Lisäksi toinen fenotyyppisen plastisuuden muoto sisältää solujen vanhenemisen, jota käsitellään yleisemmin jäljempänä, jolloin syöpäsolut, jotka indusoituvat näennäisesti peruuttamattomaan ikääntymiseen, voivat sen sijaan paeta ja jatkaa proliferatiivista laajentumista (44). Lopuksi, kuten muidenkin ominaisten ominaisuuksien kohdalla, solun plastisuus ei ole uusi keksintö tai syöpäsolujen poikkeama, vaan piilevien mutta aktivoitavien kykyjen korruptio, jota useat normaalit solut käyttävät tukemaan homeostaasia, korjausta ja regeneraatiota (45).
Kaiken kaikkiaan nämä havainnollistavat esimerkit rohkaisevat pohtimaan, että soluplastisuuden vapauttaminen erilaisten häiriintyneiden erilaistumisen muotojen mahdollistamiseksi edustaa selkeää erottuvaa kykyä, joka eroaa säätelyn ja solufenotyypin suhteen syövän hyvin validoiduista ydinpiirteistä (kuvio 2).
Epigeneettinen uudelleenohjelmointi ilman mutaatiota
Genomin (DNA) epävakauden ja mutaation mahdollistava ominaisuus on olennainen osa syövän kehittymistä ja patogeneesiä. Tällä hetkellä useat kansainväliset konsortiot luetteloivat mutaatioita koko ihmisen syöpäsolujen genomissa, lähes kaikissa ihmisen syövän tyypeissä, pahanlaatuisen etenemisen eri vaiheissa, mukaan lukien metastaattiset leesiot, ja adaptiivisen hoidon vastustuskyvyn kehittymisen aikana. Yksi tulos on nyt laajalle levinnyt tunnustus, että mutaatioita geeneissä, jotka järjestävät, moduloivat ja ylläpitävät kromatiiniarkkitehtuuria ja siten säätelevät geenien ilmentymistä maailmanlaajuisesti, löydetään yhä enemmän ja ne liittyvät toiminnallisesti syövän ominaisuuksiin (46-48).
Lisäksi on olemassa argumentteja toiselle näennäisesti riippumattomalle genomin uudelleenohjelmoinnin muodolle, joka sisältää puhtaasti epigeneettisesti säädellyt muutokset geenin ilmentymisessä, jota voitaisiin kutsua "ei-mutaatioiseksi epigeneettiseksi uudelleenohjelmoimiseksi" (kuvio 3). Itse asiassa teesi mutaatiottomasta syövän evoluutiosta ja tyypillisten syöpäfenotyyppien puhtaasti epigeneettisestä ohjelmoinnista otettiin esille lähes kymmenen vuotta sitten (49), ja siitä keskustellaan yhä enemmän (46, 50–52).
Kuva 3

Samoin kuin alkion ja kudosten erilaistumisen ja homeostaasin aikana, kerääntyvät todisteet viittaavat siihen, että tuumoreiden instrumentaalisia geenisäätelypiirejä ja -verkkoja voidaan hallita lukuisilla korruptoituneilla ja kooptoiduilla mekanismeilla, jotka ovat riippumattomia genomin epävakaudesta ja geenimutaatiosta. Syöpägrafiikan tavaramerkit otettiin käyttöön Hanahanilta ja Weinbergiltä (2).
Tietenkin käsite geeniekspression ei-mutaatiosta epigeneettistä säätelyä on vakiintunut keskeisenä mekanismina, joka välittää alkion kehitystä, erilaistumista ja organogeneesiä (53-55). Esimerkiksi aikuisella pitkäkestoiseen muistiin liittyy muutoksia geenien ja histonien modifikaatiossa, kromatiinin rakenteessa ja geenien ilmentämiskytkimien käynnistymisessä, joita positiiviset ja negatiiviset takaisinkytkentäsilmukat ylläpitävät vakaasti ajan mittaan (56, 57). Kasvava näyttö tukee ajatusta, että analogiset epigeneettiset muutokset voivat edistää tyypillisten kykyjen hankkimista kasvaimen kehittymisen ja pahanlaatuisen etenemisen aikana. Tämän hypoteesin tueksi alla on joitain esimerkkejä.
Epigeneettisen uudelleenohjelmoinnin mikroympäristömekanismit
Jos ei pelkästään onkogeenisten mutaatioiden kautta, miten syöpäsolujen genomi ohjelmoidaan uudelleen? Yhä useammat todisteet viittaavat siihen, että kasvaimen mikroympäristön poikkeavat fysikaaliset ominaisuudet voivat aiheuttaa laajoja muutoksia epigenomissa, joista ominaisuuksien fenotyyppisen valinnan kannalta hyödylliset muutokset voivat johtaa syöpäsolujen klooniseen kasvuun, jolla on parempi sopivuus proliferatiiviseen laajentumiseen.
Kasvainten (tai kasvainten sisällä olevien alueiden) yleinen piirre on riittämättömästä vaskularisaatiosta johtuva hypoksia. Hypoksia esimerkiksi vähentää TET-demetylaasien aktiivisuutta, mikä johtaa merkittäviin muutoksiin metylomissa, erityisesti hypermetylaatioon (58). Riittämätön vaskularisaatio todennäköisesti rajoittaa myös kriittisten veren kautta kulkevien ravintoaineiden biologista hyötyosuutta, ja esimerkiksi ravinteiden puutteen on osoitettu muuttavan translaation kontrollia ja siten lisäävän rintasyöpäsolujen pahanlaatuista fenotyyppiä (59).
Vakuuttava esimerkki hypoksiavälitteisestä epigeneettisestä säätelystä on poikkeuksetta kuolemaan johtavan lasten ependymooman muoto. Kuten monista alkion ja lasten kasvaimista, tästä muodosta puuttuu toistuvia mutaatioita, erityisesti ajurimutaatioiden puutetta onkogeeneissä ja kasvainsuppressoreissa. Pikemminkin näiden syöpäsolujen epänormaalin kasvun on osoitettu olevan hallinnassa hypoksian aiheuttaman geenin säätelyohjelman avulla (60, 61). Huomattavaa on, että tämän syövän oletettu alkuperäsolu sijaitsee hypoksisessa osastossa ja todennäköisesti herkistää sen sisällä olevia soluja käynnistämään tuumorigeneesin vielä tuntemattomien kofaktorien kautta.
Toinen vakuuttava todiste mikroympäristövälitteisestä epigeneettisestä säätelystä koskee syöpäsolujen invasiivista kasvukykyä. Klassinen esimerkki on syöpäsolujen invasiivisuuden palautuva induktio monien kiinteiden kasvainten reunoilla, jota ohjaa kehitystä säätelevä ohjelma, joka tunnetaan epiteelistä mesenkymaaliseen siirtymiseen (EMT; viitteet 62–64). Erityisesti EMT:n pääsäätelijän ZEB1:n osoitettiin äskettäin indusoivan histonimetyylitransferaasin, SETD1B:n, ilmentymistä, mikä puolestaan ylläpitää ZEB1:n ilmentymistä positiivisessa takaisinkytkentäsilmukassa, joka ylläpitää EMT:n (invasiivista) säätelytilaa (65).
Edellisessä tutkimuksessa dokumentoitiin vastaavasti, että EMT:n induktio sukulaisen TF:n, SNAIL1:n, lisääntyneen ilmentymisen kautta aiheutti merkittäviä muutoksia kromatiinimaisemassa useiden kromatiinimuuntajien induktion seurauksena, joiden aktiivisuuden osoitettiin olevan tarpeen fenotyyppisen tilan ylläpitämiseksi (66). Lisäksi useat tilat ja tekijät, joita syöpäsolut kokevat kasvainten reunoilla, mukaan lukien hypoksia ja stroomasolujen erittämät sytokiinit, voivat ilmeisesti indusoida EMT:tä ja siten invasiivisuutta (67, 68).
Silmiinpistävä esimerkki mikroympäristön invasiivisuuden ohjelmoinnista, jonka oletettavasti ei liity EMT-ohjelmaan, sisältää neuronaalisen signalointipiirin autokriinisen aktivoinnin, johon liittyy erittynyt glutamaatti ja sen reseptori NMDAR (69, 70). Huomattavaa on, että monien kiinteiden kasvainten prototyyppisellä jäykkyydellä, joka ilmentyy laajoissa muutoksissa solujen sisällä olevia soluja ympäröivässä ekstrasellulaarisessa matriisissa (ECM), on syvällinen vaikutus syöpäsolujen invasiivisiin ja muihin fenotyyppisiin ominaisuuksiin.
Verrattuna normaaliin kudosten ECM:ään, josta kasvaimet syntyvät, kasvaimen ECM:lle on tyypillisesti tunnusomaista lisääntynyt silloittuminen ja tiheys, entsymaattiset modifikaatiot ja muuttunut molekyylikoostumus, jotka yhdessä järjestävät, osittain integriinireseptorien kautta ECM-motiiveille, jäykkyyden indusoima signalointi ja geeniekspressioverkostot, jotka indusoivat tyypillisiä invasiivisia piirteitä (71).
Tällaisten fysikaalisen kasvaimen mikroympäristön tarjoamien säätelymekanismien lisäksi parakriininen signalointi, johon liittyy liukoisia tekijöitä, joita solutyypit vapauttavat solunulkoiseen ympäristöön kiinteitä kasvaimia kantavien eri solutyyppien kautta, voi myös edistää useiden morfologisesti erillisten invasiivisten kasvuohjelmien induktiota (72), joista vain yksi - jota kutsutaan "emenkymaaliseksi" vaikuttavaksi epigeneettiseksi säätelyksi. EMT:n mekanismi.
Epigeneettisen säätelyn heterogeenisyys
Kasvava tietopohja lisää ymmärrystä kasvaimensisäisen heterogeenisyyden tärkeydestä fenotyyppisen monimuotoisuuden synnyttämisessä, jossa proliferatiiviseen laajenemiseen ja invaasioon sopivimmat solut kasvavat veljiään ja valitaan siksi pahanlaatuisen etenemisen vuoksi. Varmasti yksi tämän fenotyyppisen heterogeenisyyden puoli johtuu kroonisesta tai episodisesta genomisesta epävakaudesta ja siitä johtuvasta geneettisestä heterogeenisyydestä kasvainta kantavissa soluissa.
Lisäksi käy yhä selvemmäksi, että ei-mutaatioon perustuvaa epigeneettistä heterogeenisuutta voi esiintyä. Merkittävä esimerkki on linkkerihistoni H1.0, joka ekspressoituu dynaamisesti ja repressoituu syöpäsolujen alapopulaatioissa useissa kasvaintyypeissä, minkä seurauksena se sekvestroituu tai saavutetaan megaemäksen kokoisia domeeneja [73]. Erityisesti syöpäsolupopulaatiolla, jossa on repressoitu H1.0, havaittiin olevan kantamaisia ominaisuuksia, parantunut kasvainaloituskyky ja yhteys potilaiden huonoon ennusteeseen.
Toinen esimerkki epigeneettisesti säädellystä plastisuudesta on kuvattu ihmisen suun levyepiteelikarsinoomissa (SCC), jossa invasiivisten reunojen syöpäsolut omaksuvat osittaisen EMT-tilan (p-EMT), josta puuttuvat edellä mainitut mesenkymaaliset TF:t, mutta jotka ilmentävät muita EMT:tä määritteleviä geenejä, joita ei ilmene kasvainten keskusytimessä (74).
p-EMT-solut eivät ilmeisesti edusta mutaatioiden muutettujen solujen klonaalista lokeroitumista: primäärikasvaimesta peräisin olevien syöpäsolujen viljelmät sisältävät sekä p-EMT hi- että p-EMT lo -solujen dynaamisia seoksia ja kun p-EMT hi/lo -solut FACS-puhdistettiin ja viljeltiin, molemmat palautuivat p-EMT hi:n ja p-EMT lo:n sekapopulaatioiksi 4 päivän kuluessa. Vaikka viereisestä stromasta saatavia parakriinisia signaaleja voidaan pitää deterministisinä p-EMT hi -tilan suhteen, näiden kahden epigeneettisen tilan vakaa läsnäolo ja regeneraatio viljelmässä puhuu syöpäsolujen sisäisestä mekanismista. Erityisesti tätä päätelmää tukee 198 solulinjan analyysi, jotka edustavat 22 syöpätyyppiä, mukaan lukien SCC, joissa 12 stabiilisti heterogeenista epigeneettistä tilaa (mukaan lukien p-EMT SCC:ssä) havaittiin eri tavoin solulinjamalleissa sekä niihin liittyvissä primaarisissa kasvaimissa (75).
Jälleen, heterogeenisiä fenotyyppisiä tiloja ei voitu yhdistää havaittavissa oleviin geneettisiin eroihin, ja useissa tapauksissa tietyn tilan FACS-lajiteltujen solujen on osoitettu tasapainottuvan dynaamisesti uudelleen viljelyssä, mikä toistaa vakaan tasapainon alkuperäisissä solulinjoissa havaittujen heterogeenisten tilojen välillä.
Lisäksi teknologiat genominlaajuiseen eri attribuuttien profilointiin – DNA-sekvenssin ja sen mutaatiovariaatioiden lisäksi – valaisevat syöpäsolugenomin annotaatiossa ja organisoinnissa vaikuttavia elementtejä, jotka korreloivat potilaan ennusteen ja yhä useammin ominaisten kykyjen kanssa (76-78). Epigenominen heterogeenisuus paljastuu yhä tehokkaammilla tekniikoilla genominlaajuisen DNA-metylaation (79, 80), histonien modifikoinnin (81), kromatiinin saatavuuden (82) ja RNA:n transkription jälkeisen muuntamisen ja translaation profilointiin (83, 84).
Haasteena tässä tarkasteltavassa postulaatissa on määrittää, millä epigenomisilla modifikaatioilla tietyissä syöpätyypeissä (i) on säätelymerkitystä ja (ii) edustavat puhtaasti ei-mutaatiota uudelleenohjelmointia, toisin kuin mutaatiolähtöinen ja siten genomin selitettävissä oleva epävakaus.
Kasvaimen mikroympäristöä kantavien stroomasolutyyppien epigeneettinen säätely
Yleisesti ottaen kasvaimen mikroympäristössä olevien apusolujen, jotka toiminnallisesti myötävaikuttavat tunnusomaisten kykyjen hankkimiseen, ei uskota kärsivän geneettisestä epävakaudesta ja mutaatioiden uudelleenohjelmoinnista niiden kasvainta edistävien toimintojen tehostamiseksi; pikemminkin päätellään, että nämä solut - syöpään liittyvät fibroblastit, synnynnäiset immuunisolut ja kasvaimen verisuoniston endoteelisolut ja perisyytit - ohjelmoidaan epigeneettisesti uudelleen niiden värväämisen yhteydessä liukoisilla ja fysikaalisilla tekijöillä, jotka määrittävät kiinteän kasvaimen mikroympäristön (2, 85).
On odotettavissa, että tällä hetkellä syöpäsoluihin sovellettavia multi-omic-profilointitekniikoita käytetään yhä enemmän kasvainten lisäsolujen (stromaalisolujen) tutkimiseen sen selvittämiseksi, kuinka normaalit solut vaurioituvat kasvaimen kehittymisen ja etenemisen tukemiseksi toiminnallisesti. Esimerkiksi tuore tutkimus (86) viittaa siihen, että tällainen uudelleenohjelmointi voi sisältää epigenomin modifikaatioita sytokiinien, kemokiinien ja kasvutekijöiden induktiivisen vaihdon lisäksi, jotka muuttavat solunsisäisiä signalointiverkkoja kaikissa näissä solutyypeissä:
Kun hiirimalleja, joilla oli keuhkojen etäpesäkkeitä, käsiteltiin DNA-metyylitransferaasi-inhibiittorin (5-atsasytidiinin) ja histonimodifikaatio-inhibiittorin (HDAC) yhdistelmällä, tunkeutuneiden myeloidisolujen havaittiin siirtyneen epäkypsästä (kasvainta edistävästä) progenitoritilasta soluihin, jotka muistuttavat kypsiä interstitiaalisia (kasvaimen kaltaisia, vastavaikuttavia) soluja. kasvaimet eivät pystyneet tukemaan tyypillisiä tehokkaan metastaattisen kolonisoinnin edellyttämiä ominaisuuksia (86). On ajateltavissa, että moniominen profilointi ja farmakologiset häiriöt auttavat selventämään uudelleenohjelmoitua epigeneettistä tilaa tällaisissa myeloidisoluissa sekä muissa tyypillisissä apusolutyypeissä, jotka kantavat kasvaimen mikroympäristöjä.
Yhteenveto
Yhdessä nämä havainnollistavat tilannekuvat tukevat väitettä, että epigeneettinen uudelleenohjelmointi ilman mutaatiota hyväksytään todelliseksi mahdollistavaksi piirteeksi, joka helpottaa tunnusomaisten kykyjen hankkimista (kuvio 3), jotka eroavat genomisen DNA:n epästabiilisuudesta ja mutaatiosta. Erityisesti ei-mutaatioon perustuvan epigeneettisen uudelleenohjelmoinnin voidaan odottaa olevan olennainen osa edellä käsitellyn fenotyyppisen plastisuuden alustavan uuden erottuvan kyvyn mahdollistamista, erityisesti dynaamisen transkription heterogeenisyyden liikkeellepanevana voimana, joka on yhä paremmin dokumentoitu pahanlaatuisten syöpäsolujen TME: ssä. Yksisoluisten moniomic-profilointitekniikoiden edistyminen valaisee vastaavia osuuksia ja vuorovaikutusta mutaatiovetoisen ja ei-mutaatiovetoisen epigeneettisen säätelyn välillä kasvainten kehittymisessä pahanlaatuisen etenemisen ja etäpesäkkeiden muodostumisen aikana.
Polymorfiset mikrobiomit
Biolääketieteen kauaskantoinen raja avautuu valaisemalla mikro-organismien runsauden monimuotoisuutta ja vaihtelua, yhteisnimitystä mikrobiota, jotka liittyvät symbioottisesti ulkoiselle ympäristölle altistuviin kehon estekudoksiin - erityisesti maha-suolikanavan orvasketeen ja sisäiseen limakalvoon, rintaan ja keuhkoihin.
Yhä enemmän tunnustetaan, että paikallisten bakteerien ja sienten luomilla ekosysteemeillä – mikrobiomeilla – on syvällisiä vaikutuksia terveyteen ja sairauksiin ( 87 ). Tämä on toteamus, joka perustuu kykyyn seuloa mikrobilajien populaatioita seuraavan sukupolven sekvensointi- ja bioinformatiikkatekniikoilla. Syövän osalta todisteet ovat yhä vakuuttavampia siitä, että mikrobiomien polymorfisella vaihtelulla populaation yksilöiden välillä voi olla syvällisiä vaikutuksia syövän fenotyyppeihin (88, 89).
Assosiaatiotutkimukset ihmisillä ja kokeellisilla manipulaatioilla syövän hiirimalleilla paljastavat tiettyjä mikro-organismeja, ensisijaisesti, mutta ei yksinomaan bakteereja, joilla voi olla joko suojaavia tai haitallisia vaikutuksia syövän kehittymiseen, pahanlaatuiseen etenemiseen ja hoitovasteeseen. Tämä koskee myös kudosmikrobiomin globaalia monimutkaisuutta ja koostumusta kokonaisuutena. Vaikka suoliston mikrobiomi oli tämän uuden rajan edelläkävijä, useat kudokset ja elimet ovat yhdistäneet mikrobiomeja, joilla on populaatiodynamiikkaan sekä mikrobilajien ja alalajien monimuotoisuuteen liittyviä erityispiirteitä.
Tämä lisääntyvä arvostus polymorfisesti vaihtelevien mikrobiomien merkityksestä terveydelle ja sairauksille herättää kysymyksen: Onko mikrobiomi erillinen mahdollistava ominaisuus, joka vaikuttaa laajasti, sekä positiivisesti että negatiivisesti, syövän erityisominaisuuksien hankkimiseen? Harkitsen tätä mahdollisuutta alla ja havainnollistan todisteita joistakin merkittävistä kudosmikrobiomista, jotka liittyvät syövän ominaisuuksiin (kuva 4), alkaen näkyvimmästä ja ilmeisesti vaikuttavimmasta mikrobiomista, suoliston mikrobiomista.
Kuva 4
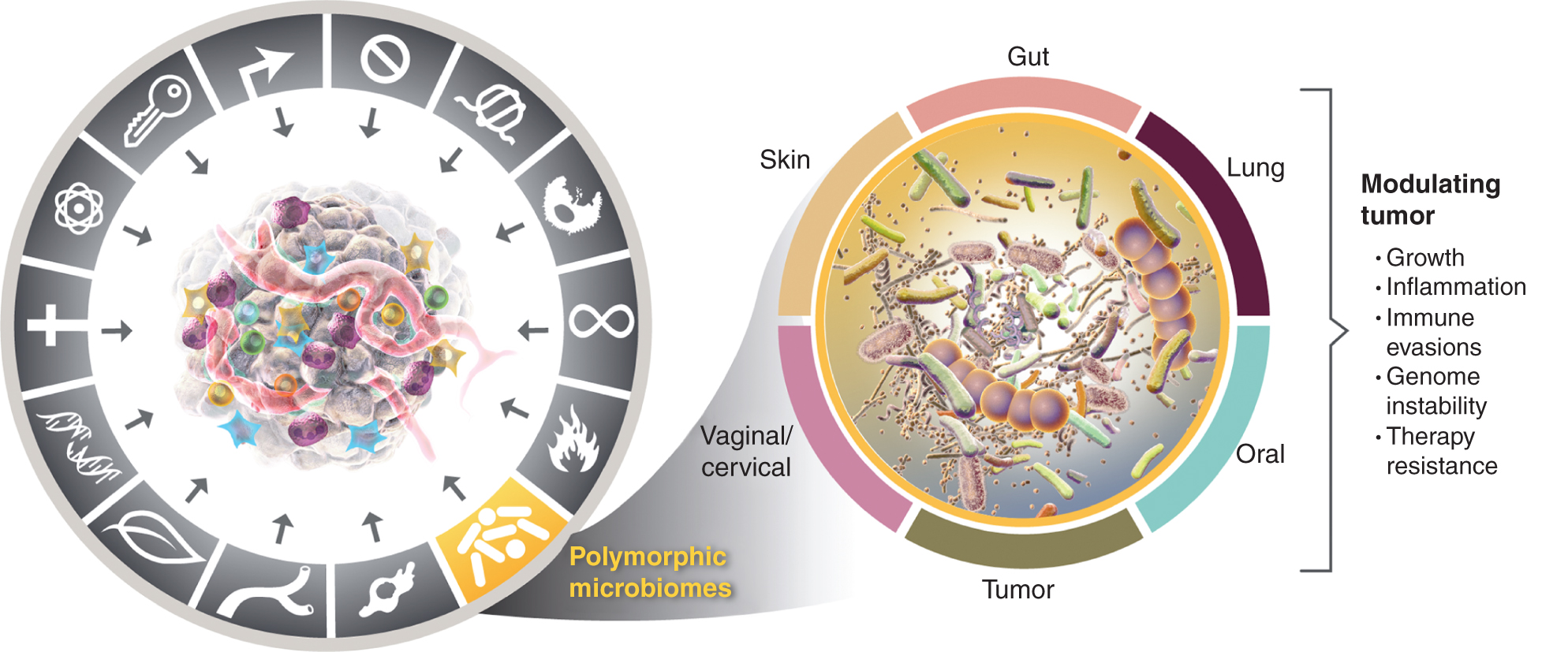
Vasemmalta, vaikka kasvaimia edistävän tulehduksen ja genomisen epävakauden ja mutaatioiden mahdollistavat ominaisuudet menevät päällekkäin, on yhä enemmän syytä päätellä, että polymorfiset mikrobiomit, jotka sijaitsevat yhdessä yksilössä toiseen verrattuna paksusuolessa, muissa limakalvoissa ja niihin liittyvissä elimissä tai kasvaimissa itsessään, voivat vaikuttaa moniin tunnusomaisiin kykyihin monin eri tavoin - joko induktion tai eston avulla - ja näin ollen, kuinka arvoituksellinen väline - ja näin ollen syöpä kehittyy, etenee ja kasvaa vastaa hoitoon. Totta, useat kudosmikrobiomit osallistuvat kasvainten fenotyyppien modulointiin. Laajasti tutkitun suoliston mikrobiomin lisäksi muut tyypilliset kudosmikrobiomit sekä kasvainmikrobiomi ovat mukana moduloimassa tietyissä kasvaintyypeissä esiintyvien tunnusomaisten kykyjen - sekä positiivisten että negatiivisten - hankkimista. Syöpägrafiikan tavaramerkit otettiin käyttöön Hanahanilta ja Weinbergiltä (2).
Useita suoliston mikrobiomin moduloivia vaikutuksia
On pitkään tiedetty, että suoliston mikrobiomi on olennainen paksusuolen (koolon) toiminnalle hajottaessa ja tuottaessa ravintoaineita kehoon osana metabolista homeostaasia, ja että paksusuolen mikrobipopulaatioiden hajoaminen – dysbioosi – voi aiheuttaa joukon fysiologisia sairauksia (87). Tämä sisältää epäilyn, että suoliston mikrobiomi vaikuttaa paksusuolen syövän herkkyyteen, kehittymiseen ja patogeneesiin. Viime vuosina vakuuttavilla toiminnallisilla tutkimuksilla, joissa on käytetty ulosteensiirtoja paksusuolen kasvaimia kantavista potilaista ja hiiristä paksusuolensyövän kehittymiselle alttiiksi vastaanottajahiiriksi, on vahvistettu periaate: on olemassa sekä syöpää suojaavia että kasvainta edistäviä mikrobiomeja, joihin liittyy tiettyjä bakteerilajeja, jotka voivat muuttaa paksusuolen kasvainten esiintymistä ja patogeneesiä (90).
Mekanismeja, joilla mikrobiota antaa nämä moduloivat roolit, selvitetään edelleen, mutta kaksi yleistä vaikutusta ovat yhä paremmin vakiintuneita kasvaimia edistäville mikrobiomeille ja joissakin tapauksissa tietyille kasvainta edistäville bakteerilajeille. Ensimmäinen vaikutus on paksusuolen epiteelin mutageneesi bakteerimyrkkyjen ja muiden molekyylien tuotannon seurauksena, jotka joko suoraan vahingoittavat DNA:ta tai häiritsevät järjestelmiä, jotka ylläpitävät genomisen eheyttä tai muuten stressaavat soluja, vaikuttaen epäsuorasti DNA:n replikaation ja korjauksen tarkkuuteen. Tyypillinen esimerkki on E. coli, joka kantaa PKS-lokusta, jonka on osoitettu mutagenisoivan ihmisen genomia ja joka osallistuu merkin mahdollistavien mutaatioiden välittämiseen (91).
Lisäksi bakteerien on raportoitu sitoutuvan paksusuolen epiteelisolujen pintaan ja tuottavan ligandijäljitelmiä, jotka stimuloivat epiteelin proliferaatiota, mikä myötävaikuttaa neoplastisten solujen tyypilliseen proliferatiiviseen signalointikykyyn (88). Toinen mekanismi, jolla tietyntyyppiset bakteerit edistävät kasvainten kehittymistä, ovat butyraattia tuottavat bakteerit, joiden runsaus on lisääntynyt potilailla, joilla on paksusuolen ja peräsuolen syöpä (92).
Metaboliitin butyraatin tuotannolla on monimutkaisia fysiologisia vaikutuksia, mukaan lukien vanhenevien epiteelisolujen ja fibroblastisolujen induktio. Butyraattia tuottavien bakteerien kanssa kolonisoitu paksusuolen karsinogeneesin hiirimalli kehitti enemmän kasvaimia kuin hiirillä, joilta tällaiset bakteerit puuttuivat; Butyraatin aiheuttaman vanhenemisen ja lisääntyneen paksusuolen kasvainten muodostumisen välinen yhteys on osoitettu käyttämällä senolyyttistä lääkettä, joka tappaa vanhenevia soluja ja heikentää kasvaimen kasvua (92).
Lisäksi bakteerien tuottamalla butyraatilla on pleiotrooppisia ja paradoksaalisia vaikutuksia erilaistuneisiin soluihin verrattuna paksusuolen epiteelin erilaistumattomiin (kanta)soluihin olosuhteissa, joissa suolistoeste on häiriintynyt (dysbioosi) ja bakteerit ovat invasiivisia, mikä vaikuttaa esimerkiksi solujen energiaan ja aineenvaihduntaan, histonin modifikaatioon, solusyklin etenemiseen sopeutuvaan tulehdukseen, joka lisää immuunivastetta. immuunivasteet (93).
Polymorfisten mikrobiomien laajaan toimintaan kuuluukin adaptiivisten ja synnynnäisten immuunijärjestelmien moduloiminen erilaisten reittien kautta, mukaan lukien bakteerien "immunomoduloivien" tekijöiden tuottaminen, jotka aktivoivat vaurioantureita epiteelisoluissa tai paikallisissa immuunisoluissa, mikä johtaa monimuotoisen kemokiinien ja sytokiinien ilmentymiseen, ja epiteelisolujen ominaisuudet voivat muotoilla immunokolliumin soluja ja soluja. taustalla oleva strooma ja tyhjennysimusolmukkeet.
Lisäksi tietyt bakteerit voivat rikkoa sekä suojaavan biokalvon että liman, joka peittää paksusuolen epiteelin, ja häiritä epiteelisolujen ja solujen tiiviitä liitoksia, jotka yhdessä ylläpitävät fyysisen esteen eheyttä, joka normaalisti lokeroi suoliston mikrobiomia. Tunkeutuessaan stromaan bakteerit voivat laukaista sekä synnynnäisiä että adaptiivisia immuunivasteita saamalla erittymään sytokiinien ja kemokiinien valikoima. Yksi ilmentymä voi olla kasvainta edistävien tai kasvainta antagonisoivien immuuni-mikroympäristöjen luominen, jotka näin ollen suojaavat tuumorin muodostumiselta ja pahanlaatuiselta etenemiseltä tai helpottavat niitä.
Vastaavasti yksittäisten potilaiden (i) (synnynnäisen) kasvainta edistävän tulehduksen indusoimisen ja (ii) tyypillisten mikrobiomien aiheuttaman (adaptiivisen) immuuni tuhoutumisen välttämisen toisiinsa kietoutuneiden parametrien modulointi voi liittyä ennusteen lisäksi myös vasteeseen tai resistenssiin immunoterapiaa vastaan immuunitarkistuspisteen estäjiä ja muita kasvaimen estäjiä ja muita terapeuttisia ilmenemismuotoja vastaan. mikroympäristöt, joita näin ollen esiintyy Suojaa tai helpottaa kasvaimen kehittymistä ja pahanlaatuista etenemistä.
Vastaavasti yksittäisten potilaiden (i) (synnynnäisen) kasvainta edistävän tulehduksen indusoimisen ja (ii) tyypillisten mikrobiomien aiheuttaman (adaptiivisen) immuuni tuhoutumisen välttämisen toisiinsa kietoutuneiden parametrien modulointi voi liittyä ennusteen lisäksi myös vasteeseen tai resistenssiin immunoterapiaa vastaan immuunitarkistuspisteen estäjiä ja muita kasvaimen estäjiä ja muita terapeuttisia ilmenemismuotoja vastaan. mikroympäristöt, joita näin ollen esiintyy, suojelevat tai edistävät kasvaimen kehittymistä ja pahanlaatuista etenemistä).
Näin ollen yksittäisten potilaiden (i) (synnynnäisen) kasvainta edistävän tulehduksen induktion ja (ii) erottuvien mikrobiomien (adaptiiviselta) immuuni tuholta paeta toisiinsa kietoutuneiden parametrien modulointi voi liittyä ennusteen lisäksi myös vasteeseen tai resistenssiin immuunivasteen estäjiä ja muita terapeuttisia menetelmiä vastaan (89, 94). Alustava todiste käsitteestä on peräisin viimeaikaisista tutkimuksista, jotka osoittavat immunoterapian tehokkuuden palautuneen sen jälkeen, kun hoitoon reagoineilta potilailta on siirretty ulosteen mikrobiota potilaille, joilla on melanooma, joka oli edennyt aikaisemman immuunitarkastuspisteen salpaushoidon aikana (97, 98).
Molekyylimekanismit, joilla suoliston mikrobiomin erilaiset ja vaihtelevat komponentit säätelevät systeemisesti adaptiivisen immuunijärjestelmän aktiivisuutta, pysyvät jatkuvana mysteerinä joko tehostamalla immuunitarkastuspisteen salpauksen aiheuttamia kasvaimia estäviä immuunivasteita tai pikemminkin indusoimalla systeemistä tai paikallista (kasvainnsisäistä) immunosuppressiota. Tuore tutkimus on tuonut valoa: tietyt Enterococcus-kannat (ja muut bakteerit) ilmentävät SagA-nimistä peptidoglykaanihydrolyaasia, joka vapauttaa bakteerin seinämästä mukopeptidejä, jotka voivat sitten kiertää systeemisesti ja aktivoida NOD2-kuvioreseptorin, mikä puolestaan lisää T-soluvasteita ja tarkistuspisteimmunoterapian tehokkuutta (99).
Muita tiettyjen bakteerialalajien tuottamia immunosäätelymolekyylejä tunnistetaan ja toiminnallisesti arvioidaan, mukaan lukien bakteerien tuottama inosiini, T-solutoiminnan nopeutta rajoittava metaboliitti (100). Nämä ja muut esimerkit alkavat rajata molekyylimekanismeja, joilla polymorfiset mikrobiomit epäsuorasti ja systeemisesti moduloivat kasvaimen immunobiologiaa, yli ja yli immuunivasteiden, jotka seuraavat bakteerien suoria fyysisiä vuorovaikutuksia immuunijärjestelmän kanssa (101, 102).
Paitsi syy-yhteydet paksusuolen syöpään ja melanoomaan, suoliston mikrobiomin osoitettu kyky saada aikaan immunomoduloivien kemokiinien ja sytokiinien ilmentymistä, jotka tulevat systeemiseen verenkiertoon, pystyy myös ilmeisesti vaikuttamaan syövän patogeneesiin ja hoitovasteeseen muissa kehon elimissä (94, 95).
Valaiseva esimerkki koskee kolangiokarsinoomien kehittymistä maksassa: suoliston dysbioosi mahdollistaa bakteerien ja bakteerituotteiden pääsyn ja kuljetuksen porttilaskimon kautta maksaan, jossa maksasoluissa ilmentynyt TLR4 laukeaa indusoimaan kemokiinin CXCL1 ilmentymistä, joka värvää CXCR2:ta ekspressoivia soluja, jotka palvelevat luonnollisia granulosyyttisiä myel-soluja. välttää immuunijärjestelmän tuhoa (103) ja todennäköisesti välittää muita erityisiä kykyjä (85). Sellaisenaan suoliston mikrobiomi on selkeästi mukana mahdollistava ominaisuus, joka voi vaihtoehtoisesti helpottaa useita syöpiä tai suojata niitä vastaan.
Suoliston ulkopuolella: Erillisten mikrobiomien vaikuttaminen muihin estekudoksiin
Lähes kaikki kudokset ja elimet, jotka ovat suoraan tai epäsuorasti alttiina ulkoiselle ympäristölle, ovat myös kommensaalisten mikro-organismien varastoja (104). Toisin kuin suolistossa, jossa mikrobiomin symbioottinen rooli aineenvaihdunnassa tunnetaan hyvin, näissä erilaisissa paikoissa asuvan mikrobiston normaalit ja patogeeniset roolit ovat edelleen esiin nousemassa.
Homeostaasin, ikääntymisen ja syövän mikrobiomien rakenteessa on ilmeisiä elin-/kudosspesifisiä eroja, sekä päällekkäisiä että erottuvia lajeja ja esiintymistiheyksiä paksusuolen vastaaviin (104, 105). Lisäksi assosiaatiotutkimukset tarjoavat yhä enemmän todisteita siitä, että paikalliset kasvaimia antagonisoivat/suojaavat verrattuna kasvainta edistäviin kudosmikrobiomiin, jotka ovat samankaltaisia kuin suoliston mikrobiomi, voivat moduloida alttiutta ja patogeneesiä niihin liittyvissä elimissä esiintyville ihmisen syöville (106-109).
Kasvaimensisäisen mikrobiotan vaikutus?
Lopuksi patologit ovat pitkään havainneet, että bakteereja voidaan havaita kiinteistä kasvaimista, mikä on nyt vahvistettu kehittyneillä profilointitekniikoilla. Esimerkiksi tutkimuksessa, jossa käsiteltiin 1 526 kasvainta, jotka kattavat seitsemän ihmisen syöpätyyppiä (luu-, aivo-, rinta-, keuhko-, melanooma-, munasarja- ja haimasyöpä), jokaiselle tyypille oli ominaista erottuva mikrobiomi, joka sijaitsee suurelta osin syöpäsoluissa ja immuunisoluissa. Jokaisessa kasvaintyypissä kasvaimen mikrobiomin vaihtelut on osoitettu ja niiden on katsottu liittyvän kliiniset patologisiin piirteisiin (110).
Mikrobioota on havaittu vastaavasti de novo geneettisesti muokatuissa keuhkosyövän ja haimasyövän hiirimalleissa, ja niiden puuttumisen bakteerivapailla hiirillä ja/tai niiden poistamisen antibiooteilla voidaan osoittaa heikentävän tuumorin muodostumista, mikä merkitsee kasvaimen mikrobiomia toiminnallisesti kasvainta edistävän tulehduksen ja pahanlaatuisen etenemisen edeltäjänä (11211).
Ihmisen haiman duktaalisen adenokarsinooman assosiaatiotutkimukset ja toiminnalliset määritykset ulosteensiirrolla kasvaimia kantaviin hiiriin ovat osoittaneet, että vaihtelut kasvaimen mikrobiomissa – ja siihen liittyvässä suoliston mikrobiomissa – moduloivat immuunijärjestelmän fenotyyppejä ja eloonjäämistä (113). Tärkeä tulevaisuuden haaste on laajentaa näitä vaikutuksia muihin kasvaintyyppeihin ja erottaa potentiaalisesti erotettavissa olevat tuumorin mikrobiomin rakenteiden ja variaatioiden osat suoliston mikrobiomista (ja paikallisesta alkuperäkudoksesta), ehkä tunnistamalla tietyt mikrobilajit, jotka ovat toiminnallisesti vaikuttavia jossakin paikassa.
Yhteenveto
Mielenkiintoisia tulevaisuuden kysymyksiä ovat muun muassa, pystyykö eri kudoksissa asuva tai alkavia kasvaimia asutteleva mikrobiota edistämään tai häiritsemään muiden tunnusomaisten kykyjen hankkimista immunomodulaation ja genomisen mutaation lisäksi, mikä vaikuttaa kasvaimen kehittymiseen ja etenemiseen. On näyttöä siitä, että tietyt bakteerilajit voivat suoraan stimuloida proliferatiivisen signaloinnin tunnusmerkkiä, esimerkiksi paksusuolen epiteelissä (88) ja moduloida kasvun suppressiota muuttamalla kasvainsuppressoriaktiivisuutta suolen eri osissa (114), kun taas suorat vaikutukset muihin ominaisiin kykyihin, kuten solukuoleman välttäminen, metastaasien yleistyminen, verisuonten muodostumisen laukaiseminen ja stimulaatio säilyvät. näistä havainnoista moniin ihmisen syövän muotoihin.
Siitä huolimatta on yhä vakuuttavampia väitteitä siitä, että polymorfinen vaihtelu suoliston ja muiden elinten mikrobiomissa edustaa erottuvaa aktivoivaa piirrettä erottuvien taitojen hankkimisessa (kuva 4), vaikka se on päällekkäinen genomin epävakauden ja mutaatioiden sekä kasvainta edistävän tulehduksen kanssa ja täydentää niitä.
Vanhenevat solut
Solujen vanheneminen on tyypillisesti peruuttamaton proliferatiivisen pysähtymisen muoto, joka todennäköisesti kehittyi suojaavaksi mekanismiksi kudosten homeostaasin ylläpitämiseksi, näennäisesti täydentävänä mekanismina ohjelmoitua solukuolemaa varten, jonka tehtävänä on inaktivoida ja aikanaan poistaa sairaita, toimintahäiriöitä tai muuten tarpeettomia soluja. Sen lisäksi, että vanhenemisohjelma pysäyttää solunjakautumissyklin, se tuottaa muutoksia solun morfologiaan ja aineenvaihduntaan ja ennen kaikkea ikääntymiseen liittyvän sekretorisen fenotyypin (SASP) aktivoitumisen, mikä sisältää lukuisten bioaktiivisten proteiinien, mukaan lukien kemokiinien, vapautumisen.
Sytokiinit ja proteaasit, joiden identiteetti riippuu solu- ja kudostyypistä, josta vanheneva solu syntyy (115–117). Vanheneminen voi indusoitua soluissa useiden eri olosuhteiden vuoksi, mukaan lukien mikroympäristön stressit, kuten ravinteiden nälkä ja DNA-vauriot, sekä soluelinten ja soluinfrastruktuurin vauriot ja solujen signaaliverkkojen epätasapaino (115, 117), jotka kaikki ovat tapahtuneet havaitun vanhenevien solujen tiheyden lisääntymisen yhteydessä (1,1,18 eri elimissä18).
Solujen vanhenemista on pitkään pidetty suojaavana mekanismina neoplasiaa vastaan, mikä aiheuttaa syöpäsolujen vanhenemista (120). Suurin osa edellä mainituista vanhenemisohjelman käynnistäjistä liittyy pahanlaatuisuuteen, erityisesti poikkeavasta hyperproliferaatiosta johtuvaan DNA-vaurioon, ns. onkogeenin aiheuttamaan ikääntymiseen hyperaktivoituneen signaloinnin seurauksena ja hoidon aiheuttamaan vanhenemiseen solunsalpaaja- ja sädehoidon aiheuttamien solu- ja genomivaurioiden seurauksena.
Itse asiassa on olemassa vakiintuneita esimerkkejä ikääntymisen suojaavista eduista pahanlaatuisen etenemisen rajoittamisessa (118, 119). Päinvastoin, kasvava määrä todisteita osoittaa juuri päinvastaista: tietyissä yhteyksissä vanhenevat solut stimuloivat eri tavalla kasvaimen kehittymistä ja pahanlaatuista etenemistä (119, 121).
Oivaltavassa tapaustutkimuksessa ikääntyvien hiirten vanhenevat solut poistettiin farmakologisesti, mikä erityisesti tuhosi vanhenevia soluja, jotka ilmentävät tyypillisesti solusyklin estäjää p16 – INK4a: useiden ikään liittyvien oireiden viivästymisen lisäksi tämä johti ikääntyvien hiirten vanhenevien solujen ehtymiseen, mikä vähensi spontaanien kasvainten muodostumisen ja syöpäkuolemien esiintymistä (-1).
Päämekanismin, jolla vanhenevat solut edistävät kasvainfenotyyppejä, uskotaan olevan SASP, jonka on osoitettu pystyvän välittämään signalointimolekyylejä (ja proteaaseja, jotka aktivoituvat ja/tai deaktivoivat) parakriinisella tavalla välittääkseen tyypillisiä ominaisuuksia. Siten eri kokeellisissa järjestelmissä vanhenevien syöpäsolujen on osoitettu osallistuvan eri tavoin proliferatiiviseen signalointiin, välttävän apoptoosia, indusoivan angiogeneesiä, stimuloivan invaasiota ja metastasoitumista ja tukahduttavan tuumoriimmuniteettia (116, 118, 120, 121).
Vielä yksi puoli vanhenevien syöpäsolujen vaikutuksista syöpäfenotyyppeihin sisältää ohimeneviä, palautuvia vanhenevia solutiloja, jolloin vanhenevat syöpäsolut voivat paeta SASP:tä ilmentävästä, ei-proliferatiivisesta tilastaan ja jatkaa solujen lisääntymistä ja siihen liittyvien täysin elinkelpoisten onkogeenisolujen kykyjen ilmentymistä (44).
Tällainen ohimenevä vanheneminen on parhaiten dokumentoitu hoitoresistenssin tapauksissa (44), joka edustaa hiljentymisen muotoa, joka välttää proliferoituvien syöpäsolujen terapeuttisen kohdistamisen, mutta voi osoittautua laajemmin tehokkaammaksi kasvaimen kehittymisen, pahanlaatuisen etenemisen ja etäpesäkkeiden muissa vaiheissa.
Lisäksi vanhenevien solujen tunnusmerkkejä edistävät kyvyt eivät rajoitu vanheneviin syöpäsoluihin. Syöpään liittyvien fibroblastien (CAF) on osoitettu vanhenevan kasvaimissa aiheuttaen vanhenevia CAF:eja, joiden on osoitettu olevan kasvainta edistäviä antamalla TME:ssä syöpäsoluille tunnusomaisia kykyjä (115, 116, 121).
Lisäksi normaaleissa kudoksissa olevat vanhenevat fibroblastit, jotka muodostuvat osittain luonnollisesta ikääntymisestä tai ympäristön aiheuttamista loukkauksista, osallistuvat samalla tavalla kudosten mikroympäristöjen uudelleenmuokkaamiseen SASP:n kautta tarjotakseen parakriinistä tukea paikalliselle tunkeutumiselle (niin sanotuille "kenttävaikutuksille") ja lähistöllä kehittyvien kasvainten etäpesäkkeille (116).
Lisäksi ikääntyvän ihon ikääntyvien fibroblastien on osoitettu värväävän – SASP:n kautta – synnynnäisiä immuunisoluja, jotka sekä immunosuppressoivat CD8 T-soluihin ankkuroituja adaptiivisia kasvaimia estäviä immuunivasteita ja stimuloivat ihokasvaimen kasvua (123), jälkimmäinen vaikutus mahdollisesti heijastaa tällaisten synnynnäisten immuunisolujen, myelofiilisolujen ja muiden myelofiloidisolujen (myelhabiliges) parakriinisiä vaikutuksia. heijastaa.
Vaikkakin vähemmän vakiintunut, näyttää todennäköiseltä, että muut runsaat stroomasolut, jotka asuttavat spesifisiä kasvainten mikroympäristöjä, vanhenevat, mikä muuttaa syövän ominaisuuksia ja tuloksena olevia kasvainfenotyyppejä. Esimerkiksi hoidon indusoimat vanhenevat kasvaimen endoteelisolut voivat tehostaa proliferaatiota, invaasiota ja etäpesäkkeitä rintasyöpämalleissa (124, 125).
Varmasti tällaiset todisteet ansaitsevat tutkimuksen muissa kasvaintyypeissä fibroblastien, endoteelisolujen ja muiden stroomasolujen yleisen vanhenemisen arvioimiseksi kasvaimen kehittymisen liikkeellepanevana voimana. Tällä hetkellä epäselviä ovat myös säätelymekanismit ja toiminnalliset determinantit, joilla tietty ikääntyvä solutyyppi tietyssä TME:ssä saa aikaan kasvainta edistävän vs. kasvainta antagonistisen SASP:n, joka ilmeisesti voidaan indusoida vaihtoehtoisesti samassa vanhenevassa solutyypissä, ehkä eri initiaattoreiden toimesta, kun ne upotetaan tyypillisiin fysiologisiin ja neoplastisiin mikroympäristöihin.
Yhteenveto
Käsite, jonka mukaan kasvaimet koostuvat geneettisesti muunnetuista syöpäsoluista, jotka ovat vuorovaikutuksessa värvättyjen ja epigeneettisesti/fenotyyppisesti korruptoituneiden (strooman) lisäsolujen kanssa ja hyötyvät niistä, on todettu ratkaisevan tärkeäksi syövän patogeneesille. Edellä käsitellyt ja tässä (ja muualla) lainatuissa katsauksissa ja raporteissa kuvatut näkökohdat väittävät vakuuttavasti, että ikääntyvien solujen (solujen alkuperästä riippumatta) sisällyttämistä tuumorin mikroympäristön toiminnallisesti merkittävien solujen luetteloon tulisi harkita (kuvio 5). Siksi vanhenevia soluja tulisi harkita etsiessään syvällistä tietoa syöpämekanismeista. Lisäksi niiden tärkeyden tunnustaminen motivoi toissijaista tavoitetta kohdistaa terapeuttisesti tuumoreita edistäviin vanheneviin soluihin, joilla on kaikki rakennelmat, joko farmakologisen tai immunologisen ablaation avulla tai ohjelmoimalla SASP uudelleen kasvainta antagonisoiviksi varianteiksi (115, 121, 126).
Kuva 5

Heterogeeniset syöpäsolujen alatyypit ja stroomasolutyypit ja -alatyypit ovat toiminnallisesti integroituneet kasvainten ilmenemismuotoihin laittomina eliminä. Yhä useammat todisteet viittaavat siihen, että monien näiden TME:n solukomponenttien vanhenevat solujohdannaiset ja niiden vaihtelevat SASP:t osallistuvat tunnusomaisten ominaisuuksien ja niistä aiheutuvien kasvainfenotyyppien modulaatioon. Syöpägrafiikan tavaramerkit otettiin käyttöön Hanahanilta ja Weinbergiltä (2).
Loppuhuomautukset
Vaikka syövän kahdeksalla tunnusmerkillä ja niitä tukevilla kahdella ominaisuudella on osoittautunut pysyväksi heuristiseksi arvoksi syövän käsitteellistämisessä, edellä esitetyt pohdinnat viittaavat siihen, että voi olla uusia yleisiä puolia ja siksi tärkeitä taudin monimutkaisuuden, mekanismien ja ilmenemismuotojen täydellisemmälle ymmärtämiselle. Soveltamalla havaittavissa olevan, ellei täydellisen riippumattomuuden mittaria 10 ydinattribuutista, voidaan väittää, että nämä neljä parametria - lisävalidoinnin ja yleistyksen jälkeen esitettyjen tapaustutkimusten lisäksi - voidaan hyvinkin integroida syöpäskeeman tunnusmerkkeihin (kuva 6).
Siksi soluplastisuus voitaisiin lisätä merkittävien ominaisuuksien luetteloon. Vaikka kahdeksas ydin ja tämä nouveau-kyky ovat kukin käsitteellisesti erotettavissa tunnusmerkkeinä määritellyt ominaisuudet, niiden säätelyn näkökohdat liittyvät ainakin osittain joihinkin ja ehkä moniin syöpiin. Esimerkiksi kanoniset onkogeeniset tekijät moduloivat koordinoidusti useita tunnusmerkkejä joissakin kasvaintyypeissä, mukaan lukien
- (I) KRAS ( https://cancer.sanger.ac.uk/cosmic/census-page/KRAS ),
- (II) MYC ( https://cancer.sanger.ac.uk/cosmic/census-page/MYC ),
- (III) NOTCH ( https://cancer.sanger.ac.uk/cosmic/census-page/NOTCH1 ; Ref. 127) und
- (IV) TP53 ( https://cancer.sanger.ac.uk/cosmic/census-page/TP53 )
Kuva 6
Kanoniset ja odotetut uudet lisäykset "Syövän tunnusmerkkeihin" näytetään. Tämä asiakirja herättää keskustelun, keskustelun ja kokeellisen kehittelyn herättämiseksi mahdollisuuden, että jotkin tai kaikki neljästä uudesta parametrista tunnustetaan yleisiksi useille ihmisen syövän muodoille ja siksi sopivat integroitavaksi syövän tunnusmerkkien ydinkäsitteelliseen muotoon. Syöpägrafiikan tavaramerkit otettiin käyttöön Hanahanilta ja Weinbergiltä (2).
Sen lisäksi, että luetteloon lisätään soluplastisuutta, ei-mutaatiota epigeneettistä uudelleenohjelmointia ja polymorfisia variaatioita voidaan integroida elinten/kudosten mikrobiomiin mekaanisina determinantteina – mahdollistavina ominaisuuksina – joiden kautta hankitaan erottuvia ominaisuuksia sekä kasvainta edistävää tulehdusta (jotka ovat osittain yhteydessä toisiinsa mikrobiomiin, jotka ilmenevät edellä mainittujen mutaatioiden lisäksi).
Lopuksi TME:n geneerisiksi komponenteiksi voidaan sisällyttää eri alkuperää olevia ikääntyviä soluja – mukaan lukien syöpäsolut ja erilaiset stroomasolut – jotka toiminnallisesti edistävät syövän kehittymistä ja pahanlaatuista etenemistä, vaikkakin selvästi eri tavoin kuin niiden ei-vanhenevat veljet. Yhteenvetona voidaan todeta, että näiden alustavien "kokeellisten ilmapallojen" käyttöönoton odotetaan herättävän keskustelua, keskustelua ja lisäkokeellista tutkimusta syöpätutkimusyhteisössä syövän biologian, genetiikan ja patogeneesin käsitteellisten parametrien määrittelystä.
Viitteet
- Hanahan D , Weinberg RA . The hallmarks of cancer. Cell 2000;100:57–70.
- Hanahan D , Weinberg RA . Hallmarks of cancer: the next generation. Cell 2011;144:646–74.
- Yuan S , Norgard RJ , Stanger BZ . Cellular plasticity in cancer. Cancer Discov 2019;9:837–51.
- Barker N , Ridgway RA , van Es JH , van de Wetering M , Begthel H , van den Born M et al . Crypt stem cells as the cells-of-origin of intestinal cancer. Nature 2009;457:608–11.
- Perekatt AO , Shah PP , Cheung S , Jariwala N , Wu A , Gandhi V et al . SMAD4 suppresses WNT-driven dedifferentiation and oncogenesis in the differentiated gut epithelium. Cancer Res 2018;78:4878–90.
- Shih IM , Wang TL , Traverso G , Romans K , Hamilton SR , Ben-Sasson S et al . Top-down morphogenesis of colorectal tumors. Proc Natl Acad Sci U S A 2001;98:2640–5.
- Ordóñez-Morán P , Dafflon C , Imajo M , Nishida E , Huelsken J . HOXA5 counteracts stem cell traits by inhibiting Wnt signaling in colorectal cancer. Cancer Cell 2015;28:815–29.
- Tan SH , Barker N . Stemming colorectal cancer growth and metastasis: HOXA5 forces cancer stem cells to differentiate. Cancer Cell 2015;28:683–5.
- Köhler C , Nittner D , Rambow F , Radaelli E , Stanchi F , Vandamme N et al . Mouse cutaneous melanoma induced by mutant BRaf arises from expansion and dedifferentiation of mature pigmented melanocytes. Cell Stem Cell 2017;21:679–93.
- Shah M , Bhoumik A , Goel V , Dewing A , Breitwieser W , Kluger H et al . A role for ATF2 in regulating MITF and melanoma development. PLoS Genet 2010;6:e1001258.
- Claps G , Cheli Y , Zhang T , Scortegagna M , Lau E , Kim H et al . A transcriptionally inactive ATF2 variant drives melanomagenesis. Cell Rep 2016;15:1884–92.
- Saghafinia S , Homicsko K , Di Domenico A , Wullschleger S , Perren A , Marinoni I et al . Cancer cells retrace a stepwise differentiation program during malignant progression. Cancer Discov 2021;11:2638–57.
- Yu X-X , Qiu W-L , Yang L , Zhang Y , He M-Y , Li L-C et al . Defining multistep cell fate decision pathways during pancreatic development at single-cell resolution. EMBO J 2019;38:e100164.
- de Thé H . Differentiation therapy revisited. Nat Rev Cancer 2018;18:117–27.
- He LZ , Merghoub T , Pandolfi PP . In vivo analysis of the molecular pathogenesis of acute promyelocytic leukemia in the mouse and its therapeutic implications. Oncogene 1999;18:5278–92.
- Warrell RP , de Thé H , Wang ZY , Degos L . Acute promyelocytic leukemia. N Engl J Med 1993;329:177–89.
- Bots M , Verbrugge I , Martin BP , Salmon JM , Ghisi M , Baker A et al . Differentiation therapy for the treatment of t(8;21) acute myeloid leukemia using histone deacetylase inhibitors. Blood 2014;123:1341–52.
- Ferrara FF , Fazi F , Bianchini A , Padula F , Gelmetti V , Minucci S et al . Histone deacetylase-targeted treatment restores retinoic acid signaling and differentiation in acute myeloid leukemia. Cancer Res 2001;61:2–7.
- Kaufman CK , Mosimann C , Fan ZP , Yang S , Thomas AJ , Ablain J et al . A zebrafish melanoma model reveals emergence of neural crest identity during melanoma initiation. Science 2016;351:aad2197.
- Morris JP , Yashinskie JJ , Koche R , Chandwani R , Tian S , Chen C-C et al . α-Ketoglutarate links p53 to cell fate during tumour suppression. Nature 2019;573:595–9.
- Saha SK , Parachoniak CA , Ghanta KS , Fitamant J , Ross KN , Najem MS et al . Mutant IDH inhibits HNF-4α to block hepatocyte differentiation and promote biliary cancer. Nature 2014;513:110–4.
- Dang L , Su S-SM . Isocitrate dehydrogenase mutation and (R)-2-hydroxyglutarate: from basic discovery to therapeutics development. Annu Rev Biochem 2017;86:305–31.
- Waitkus MS , Diplas BH , Yan H . Biological role and therapeutic potential of IDH mutations in cancer. Cancer Cell 2018;34:186–95.
- Phan TG , Croucher PI . The dormant cancer cell life cycle. Nat Rev Cancer 2020;20:398–411.
- Jiang M , Azevedo-Pouly AC , Deering TG , Hoang CQ , DiRenzo D , Hess DA et al . MIST1 and PTF1 collaborate in feed-forward regulatory loops that maintain the pancreatic acinar phenotype in adult mice. Mol Cell Biol 2016;36:2945–55.
- Krah NM , Narayanan SM , Yugawa DE , Straley JA , Wright CVE , MacDonald RJ et al . Prevention and reversion of pancreatic tumorigenesis through a differentiation-based mechanism. Dev Cell 2019;50:744–54.
- Krah NM , De La O J-P , Swift GH , Hoang CQ , Willet SG , Chen Pan F et al . The acinar differentiation determinant PTF1A inhibits initiation of pancreatic ductal adenocarcinoma. eLife 2015;4:e07125.
- Shi G , DiRenzo D , Qu C , Barney D , Miley D , Konieczny SF . Maintenance of acinar cell organization is critical to preventing Kras-induced acinar-ductal metaplasia. Oncogene 2013;32:1950–8.
- Kopp JL , von Figura G , Mayes E , Liu F-F , Dubois CL , Morris JP et al . Identification of Sox9-dependent acinar-to-ductal reprogramming as the principal mechanism for initiation of pancreatic ductal adenocarcinoma. Cancer Cell 2012;22:737–50.
- Julian LM , McDonald AC , Stanford WL . Direct reprogramming with SOX factors: masters of cell fate. Curr Opin Genet Dev 2017;46:24–36.
- Grimm D , Bauer J , Wise P , Krüger M , Simonsen U , Wehland M et al . The role of SOX family members in solid tumours and metastasis. Semin Cancer Biol 2020;67:122–53.
- Mu P , Zhang Z , Benelli M , Karthaus WR , Hoover E , Chen C-C et al . SOX2 promotes lineage plasticity and antiandrogen resistance in TP53- and RB1-deficient prostate cancer. Science 2017;355:84–8.
- Von Hoff DD , LoRusso PM , Rudin CM , Reddy JC , Yauch RL , Tibes R et al . Inhibition of the hedgehog pathway in advanced basal-cell carcinoma. N Engl J Med 2009;361:1164–72.
- Biehs B , Dijkgraaf GJP , Piskol R , Alicke B , Boumahdi S , Peale F et al . A cell identity switch allows residual BCC to survive Hedgehog pathway inhibition. Nature 2018;562:429–33.
- Boumahdi S , de Sauvage FJ . The great escape: tumour cell plasticity in resistance to targeted therapy. Nat Rev Drug Discov 2020;19:39–56.
- Groves SM , Ireland A , Liu Q , Simmons AJ , Lau K , Iams WT et al . Cancer Hallmarks Define a Continuum of Plastic Cell States between Small Cell Lung Cancer Archetypes [Internet]. Systems Biology; 2021 Jan. Available from: http://biorxiv.org/lookup/doi/10.1101/2021.01.22.427865.
- LaFave LM , Kartha VK , Ma S , Meli K , Del Priore I , Lareau C et al . Epigenomic state transitions characterize tumor progression in mouse lung adenocarcinoma. Cancer Cell 2020;38:212–28.
- Marjanovic ND , Hofree M , Chan JE , Canner D , Wu K , Trakala M et al . Emergence of a high-plasticity cell state during lung cancer evolution. Cancer Cell 2020;38:229–46.
- Drapkin BJ , Minna JD . Studying lineage plasticity one cell at a time. Cancer Cell 2020;38:150–2.
- Inoue Y , Nikolic A , Farnsworth D , Liu A , Ladanyi M , Somwar R et al . Extracellular signal-regulated kinase mediates chromatin rewiring and lineage transformation in lung cancer [Internet]. Cancer Biology; 2020 Nov. Available from: http://biorxiv.org/lookup/doi/10.1101/2020.11.12.368522.
- Dravis C , Chung C-Y , Lytle NK , Herrera-Valdez J , Luna G , Trejo CL et al . Epigenetic and transcriptomic profiling of mammary gland development and tumor models disclose regulators of cell state plasticity. Cancer Cell 2018;34:466–82.
- Malta TM , Sokolov A , Gentles AJ , Burzykowski T , Poisson L , Weinstein JN et al . Machine learning identifies stemness features associated with oncogenic dedifferentiation. Cell 2018;173:338–54.
- Miao Z-F , Lewis MA , Cho CJ , Adkins-Threats M , Park D , Brown JW et al . A dedicated evolutionarily conserved molecular network licenses differentiated cells to return to the cell cycle. Dev Cell 2020;55:178–94.
- De Blander H , Morel A-P , Senaratne AP , Ouzounova M , Puisieux A . Cellular plasticity: a route to senescence exit and tumorigenesis. Cancers 2021;13:4561.
- Merrell AJ , Stanger BZ . Adult cell plasticity in vivo: de-differentiation and transdifferentiation are back in style. Nat Rev Mol Cell Biol 2016;17:413–25.
- Baylin SB , Jones PA . Epigenetic determinants of cancer. Cold Spring Harb Perspect Biol 2016;8:a019505.
- Flavahan WA , Gaskell E , Bernstein BE . Epigenetic plasticity and the hallmarks of cancer. Science 2017;357:eaal2380.
- Jones PA , Issa J-PJ , Baylin S . Targeting the cancer epigenome for therapy. Nat Rev Genet 2016;17:630–41.
- Huang S . Tumor progression: Chance and necessity in Darwinian and Lamarckian somatic (mutationless) evolution. Prog Biophys Mol Biol 2012;110:69–86.
- Darwiche N . Epigenetic mechanisms and the hallmarks of cancer: an intimate affair. Am J Cancer Res 2020;10:1954–78.
- Feng Y , Liu X , Pauklin S . 3D chromatin architecture and epigenetic regulation in cancer stem cells. Protein Cell 2021;12:440–54.
- Nam AS , Chaligne R , Landau DA . Integrating genetic and non-genetic determinants of cancer evolution by single-cell multi-omics. Nat Rev Genet 2021;22:3–18.
- Bitman-Lotan E , Orian A . Nuclear organization and regulation of the differentiated state. Cell Mol Life Sci CMLS 2021;78:3141–58.
- Goldberg AD , Allis CD , Bernstein E . Epigenetics: a landscape takes shape. Cell 2007;128:635–8.
- Zeng Y , Chen T . DNA methylation reprogramming during mammalian development. Genes 2019;10:257.
- Hegde AN , Smith SG . Recent developments in transcriptional and translational regulation underlying long-term synaptic plasticity and memory. Learn Mem 2019;26:307–17.
- Kim S , Kaang B-K . Epigenetic regulation and chromatin remodeling in learning and memory. Exp Mol Med 2017;49:e281.
- Thienpont B , Van Dyck L , Lambrechts D . Tumors smother their epigenome. Mol Cell Oncol 2016;3:e1240549.
- Gameiro PA , Struhl K . Nutrient deprivation elicits a transcriptional and translational inflammatory response coupled to decreased protein synthesis. Cell Rep 2018;24:1415–24.
- Lin GL , Monje M . Understanding the deadly silence of posterior fossa A ependymoma. Mol Cell 2020;78:999–1001.
- Michealraj KA , Kumar SA , Kim LJY , Cavalli FMG , Przelicki D , Wojcik JB et al . Metabolic regulation of the epigenome drives lethal infantile ependymoma. Cell 2020;181:1329–45.
- Bakir B , Chiarella AM , Pitarresi JR , Rustgi AK . EMT, MET, plasticity, and tumor metastasis. Trends Cell Biol 2020;30:764–76.
- Gupta PB , Pastushenko I , Skibinski A , Blanpain C , Kuperwasser C . Phenotypic plasticity: driver of cancer initiation, progression, and therapy resistance. Cell Stem Cell 2019;24:65–78.
- Lambert AW , Weinberg RA . Linking EMT programmes to normal and neoplastic epithelial stem cells. Nat Rev Cancer 2021;21:325–38.
- Lindner P , Paul S , Eckstein M , Hampel C , Muenzner JK , Erlenbach-Wuensch K et al . EMT transcription factor ZEB1 alters the epigenetic landscape of colorectal cancer cells. Cell Death Dis 2020;11:147.
- Javaid S , Zhang J , Anderssen E , Black JC , Wittner BS , Tajima K et al . Dynamic chromatin modification sustains epithelial-mesenchymal transition following inducible expression of Snail-1. Cell Rep 2013;5:1679–89.
- Serrano-Gomez SJ , Maziveyi M , Alahari SK . Regulation of epithelial-mesenchymal transition through epigenetic and post-translational modifications. Mol Cancer 2016;15:18.
- Skrypek N , Goossens S , De Smedt E , Vandamme N , Berx G . Epithelial-to-mesenchymal transition: epigenetic reprogramming driving cellular plasticity. Trends Genet TIG 2017;33:943–59.
- Li L , Hanahan D . Hijacking the neuronal NMDAR signaling circuit to promote tumor growth and invasion. Cell 2013;153:86–100.
- Li L , Zeng Q , Bhutkar A , Galván JA , Karamitopoulou E , Noordermeer D et al . GKAP acts as a genetic modulator of NMDAR signaling to govern invasive tumor growth. Cancer Cell 2018;33:736–51.
- Mohammadi H , Sahai E . Mechanisms and impact of altered tumour mechanics. Nat Cell Biol 2018;20:766–74.
- Odenthal J , Takes R , Friedl P . Plasticity of tumor cell invasion: governance by growth factors and cytokines. Carcinogenesis 2016;37:1117–28.
- Torres CM , Biran A , Burney MJ , Patel H , Henser-Brownhill T , Cohen A-HS et al . The linker histone H1.0 generates epigenetic and functional intratumor heterogeneity. Science 2016;353:aaf1644.
- Puram SV , Tirosh I , Parikh AS , Patel AP , Yizhak K , Gillespie S et al . Single-cell transcriptomic analysis of primary and metastatic tumor ecosystems in head and neck cancer. Cell 2017;171:1611–24.
- Kinker GS , Greenwald AC , Tal R , Orlova Z , Cuoco MS , McFarland JM et al . Pan-cancer single-cell RNA-seq identifies recurring programs of cellular heterogeneity. Nat Genet 2020;52:1208–18.
- Murtha M , Esteller M . Extraordinary cancer epigenomics: thinking outside the classical coding and promoter box. Trends Cancer 2016;2:572–84.
- Nebbioso A , Tambaro FP , Dell’Aversana C , Altucci L . Cancer epigenetics: moving forward. PLoS Genet 2018;14:e1007362.
- Tavernari D , Battistello E , Dheilly E , Petruzzella AS , Mina M , Sordet-Dessimoz J et al . Non-genetic evolution drives lung adenocarcinoma spatial heterogeneity and progression. Cancer Discov 2021;11:1490–507.
- Heyn H , Vidal E , Ferreira HJ , Vizoso M , Sayols S , Gomez A et al . Epigenomic analysis detects aberrant super-enhancer DNA methylation in human cancer. Genome Biol 2016;17:11.
- Saghafinia S , Mina M , Riggi N , Hanahan D , Ciriello G . Pan-cancer landscape of aberrant DNA methylation across human tumors. Cell Rep 2018;25:1066–80.
- Audia JE , Campbell RM . Histone modifications and cancer. Cold Spring Harb Perspect Biol 2016;8:a019521.
- Corces MR , Granja JM , Shams S , Louie BH , Seoane JA , Zhou W et al . The chromatin accessibility landscape of primary human cancers. Science 2018;362:eaav1898.
- Esteve-Puig R , Bueno-Costa A , Esteller M . Writers, readers and erasers of RNA modifications in cancer. Cancer Lett 2020;474:127–37.
- Janin M , Coll-SanMartin L , Esteller M . Disruption of the RNA modifications that target the ribosome translation machinery in human cancer. Mol Cancer 2020;19:70.
- Hanahan D , Coussens LM . Accessories to the crime: functions of cells recruited to the tumor microenvironment. Cancer Cell 2012;21:309–22.
- Lu Z , Zou J , Li S , Topper MJ , Tao Y , Zhang H et al . Epigenetic therapy inhibits metastases by disrupting premetastatic niches. Nature 2020;579:284–90.
- Thomas S , Izard J , Walsh E , Batich K , Chongsathidkiet P , Clarke G et al . The host microbiome regulates and maintains human health: a primer and perspective for non-microbiologists. Cancer Res 2017;77:1783–812.
- Dzutsev A , Badger JH , Perez-Chanona E , Roy S , Salcedo R , Smith CK et al . Microbes and cancer. Annu Rev Immunol 2017;35:199–228.
- Helmink BA , Khan MAW , Hermann A , Gopalakrishnan V , Wargo JA . The microbiome, cancer, and cancer therapy. Nat Med 2019;25:377–88.
- Sears CL , Garrett WS . Microbes, microbiota, and colon cancer. Cell Host Microbe 2014;15:317–28.
- Pleguezuelos-Manzano C , Puschhof J , Rosendahl Huber A , van Hoeck A , Wood HM , Nomburg J et al . Mutational signature in colorectal cancer caused by genotoxic pks+ E. coli. Nature 2020;580:269–73.
- Okumura S , Konishi Y , Narukawa M , Sugiura Y , Yoshimoto S , Arai Y et al . Gut bacteria identified in colorectal cancer patients promote tumourigenesis via butyrate secretion. Nat Commun 2021;12:5674.
- Salvi PS , Cowles RA . Butyrate and the intestinal epithelium: modulation of proliferation and inflammation in homeostasis and disease. Cells 2021;10:1775.
- Fessler J , Matson V , Gajewski TF . Exploring the emerging role of the microbiome in cancer immunotherapy. J Immunother Cancer 2019;7:108.
- Gopalakrishnan V , Helmink BA , Spencer CN , Reuben A , Wargo JA . The influence of the gut microbiome on cancer, immunity, and cancer immunotherapy. Cancer Cell 2018;33:570–80.
- Zitvogel L , Ma Y , Raoult D , Kroemer G , Gajewski TF . The microbiome in cancer immunotherapy: diagnostic tools and therapeutic strategies. Science 2018;359:1366–70.
- Baruch EN , Youngster I , Ben-Betzalel G , Ortenberg R , Lahat A , Katz L et al . Fecal microbiota transplant promotes response in immunotherapy-refractory melanoma patients. Science 2021;371:602–9.
- Davar D , Dzutsev AK , McCulloch JA , Rodrigues RR , Chauvin J-M , Morrison RM et al . Fecal microbiota transplant overcomes resistance to anti–PD-1 therapy in melanoma patients. Science 2021;371:595–602.
- Griffin ME , Espinosa J , Becker JL , Luo J-D , Carroll TS , Jha JK et al . Enterococcus peptidoglycan remodeling promotes checkpoint inhibitor cancer immunotherapy. Science 2021;373:1040–6.
- Mager LF , Burkhard R , Pett N , Cooke NCA , Brown K , Ramay H et al . Microbiome-derived inosine modulates response to checkpoint inhibitor immunotherapy. Science 2020;369:1481–9.
- Ansaldo E , Belkaid Y . How microbiota improve immunotherapy. Science 2021;373:966–7.
- Ansaldo E , Farley TK , Belkaid Y . Control of immunity by the microbiota. Annu Rev Immunol 2021;39:449–79.
- Zhang Q , Ma C , Duan Y , Heinrich B , Rosato U , Diggs LP et al . Gut microbiome directs hepatocytes to recruit MDSCs and promote cholangiocarcinoma. Cancer Discov 2021;11:1248–67.
- Ding T , Schloss PD . Dynamics and associations of microbial community types across the human body. Nature 2014;509:357–60.
- Byrd AL , Liu M , Fujimura KE , Lyalina S , Nagarkar DR , Charbit B et al . Gut microbiome stability and dynamics in healthy donors and patients with non-gastrointestinal cancers. J Exp Med 2021;218:e20200606.
- Healy CM , Moran GP . The microbiome and oral cancer: more questions than answers. Oral Oncol 2019;89:30-3.
- Swaney MH , Kalan LR . Living in your skin: microbes, molecules and mechanisms. Infect Immun 2021;89:e00695–20.
- Willis JR , Gabaldón T . The human oral microbiome in health and disease: from sequences to ecosystems. Microorganisms 2020;8:308.
- Xu J , Peng J-J , Yang W , Fu K , Zhang Y . Vaginal microbiomes and ovarian cancer: a review. Am J Cancer Res 2020;10:743–56.
- Nejman D , Livyatan I , Fuks G , Gavert N , Zwang Y , Geller LT et al . The human tumor microbiome is composed of tumor type-specific intracellular bacteria. Science 2020;368:973–80.
- Jin C , Lagoudas GK , Zhao C , Bullman S , Bhutkar A , Hu B et al . Commensal microbiota promote lung cancer development via γδ T cells. Cell 2019;176:998–1013.
- Pushalkar S , Hundeyin M , Daley D , Zambirinis CP , Kurz E , Mishra A et al . The pancreatic cancer microbiome promotes oncogenesis by induction of innate and adaptive immune suppression. Cancer Discov 2018;8:403–16.
- McAllister F , Khan MAW , Helmink B , Wargo JA . The tumor microbiome in pancreatic cancer: bacteria and beyond. Cancer Cell 2019;36:577–9.
- Kadosh E , Snir-Alkalay I , Venkatachalam A , May S , Lasry A , Elyada E et al . The gut microbiome switches mutant p53 from tumour-suppressive to oncogenic. Nature 2020;586:133–8.
- Birch J , Gil J . Senescence and the SASP: many therapeutic avenues. Genes Dev 2020;34:1565–76.
- Faget DV , Ren Q , Stewart SA . Unmasking senescence: context-dependent effects of SASP in cancer. Nat Rev Cancer 2019;19:439–53.
- Gorgoulis V , Adams PD , Alimonti A , Bennett DC , Bischof O , Bishop C et al . Cellular senescence: defining a path forward. Cell 2019;179:813–27.
- He S , Sharpless NE . Senescence in health and disease. Cell 2017;169:1000–11.
- Kowald A , Passos JF , Kirkwood TBL . On the evolution of cellular senescence. Aging Cell 2020;19:e13270.
- Lee S , Schmitt CA . The dynamic nature of senescence in cancer. Nat Cell Biol 2019;21:94–101.
- Wang B , Kohli J , Demaria M . Senescent cells in cancer therapy: friends or foes? Trends Cancer 2020;6:838–57.
- Baker DJ , Childs BG , Durik M , Wijers ME , Sieben CJ , Zhong J et al . Naturally occurring p16(Ink4a)-positive cells shorten healthy lifespan. Nature 2016;530:184–9.
- Ruhland MK , Loza AJ , Capietto A-H , Luo X , Knolhoff BL , Flanagan KC et al . Stromal senescence establishes an immunosuppressive microenvironment that drives tumorigenesis. Nat Commun 2016;7:11762.
- Hwang HJ , Lee Y-R , Kang D , Lee HC , Seo HR , Ryu J-K et al . Endothelial cells under therapy-induced senescence secrete CXCL11, which increases aggressiveness of breast cancer cells. Cancer Lett 2020;490:100–10.
- Wang D , Xiao F , Feng Z , Li M , Kong L , Huang L et al . Sunitinib facilitates metastatic breast cancer spreading by inducing endothelial cell senescence. Breast Cancer Res 2020;22:103.
- Amor C , Feucht J , Leibold J , Ho Y-J , Zhu C , Alonso-Curbelo D et al . Senolytic CAR T cells reverse senescence-associated pathologies. Nature 2020;583:127–32.
- Aster JC , Pear WS , Blacklow SC . The varied roles of notch in cancer. Annu Rev Pathol 2017;12:245–75.
- Kuczynski EA , Vermeulen PB , Pezzella F , Kerbel RS , Reynolds AR . Vessel co-option in cancer. Nat Rev Clin Oncol 2019;16:469–93.
Google ScholarCrossref

 Suche
Suche
 Mein Konto
Mein Konto
