Vēža raksturojums: jaunas dimensijas
Priekšvārds Vēža konceptualizācijas iezīmes ir heiristisks instruments, kas ļauj sadalīt vēža fenotipu un genotipu milzīgo sarežģītību sākotnējā pamatprincipu komplektā. Tā kā zināšanas par vēža mehānismiem ir attīstījušās, citi slimības aspekti ir parādījušies kā iespējamie uzlabojumi. Tas rada izredzes, ka fenotipiskā plastiskums un nesakārtota diferenciācija ir atšķirīga raksturīga spēja un ka nemutācijas epiģenētiskā pārprogrammēšana un polimorfie mikrobiomi ir raksturīgas veicinošas īpašības, kas atvieglo raksturīgo spēju iegūšanu. Turklāt funkcionāli svarīgu šūnu tipu sarakstam audzēja mikrovidē var pievienot dažādas izcelsmes novecojošas šūnas. Tas nozīmē, ka vēzis ir biedējošs...

Vēža raksturojums: jaunas dimensijas
Priekšvārds
Vēža konceptualizācijas iezīmes ir heiristisks rīks, lai vēža fenotipu un genotipu milzīgo sarežģītību sadalītu sākotnējā pamatprincipu komplektā. Tā kā zināšanas par vēža mehānismiem ir attīstījušās, citi slimības aspekti ir parādījušies kā iespējamie uzlabojumi. Tas rada izredzes, ka fenotipiskā plastiskums un nesakārtota diferenciācija ir atšķirīga raksturīga spēja un ka nemutācijas epiģenētiskā pārprogrammēšana un polimorfie mikrobiomi ir raksturīgas veicinošas īpašības, kas atvieglo raksturīgo spēju iegūšanu. Turklāt funkcionāli svarīgu šūnu tipu sarakstam audzēja mikrovidē var pievienot dažādas izcelsmes novecojošas šūnas.
Nozīme
Vēzis ir biedējošs savas daudzveidības plašumā un apjomā, kas ietver ģenētiku, šūnu un audu bioloģiju, patoloģiju un reakciju uz terapiju. Arvien spēcīgāki eksperimentālie un skaitļošanas rīki un tehnoloģijas nodrošina "lielu datu" lavīnu par neskaitāmajām slimību izpausmēm, ko ietver vēzis. Integratīvā koncepcija, kas ietverta vēža pazīmēs, palīdz pārvērst šo sarežģītību arvien loģiskākā zinātnē, un sākotnējās jaunās dimensijas, kas parādītas šajā perspektīvā, var dot pievienoto vērtību šiem centieniem labāk izprast kanceroģenēzes un ļaundabīgo audzēju progresēšanas mehānismus un izmantot šīs zināšanas vēža medicīnā.
ievads
Vēža pazīmes ir ierosinātas kā funkcionālo spēju kopums, ko cilvēka šūnas iegūst, pārejot no normālas uz neoplastiskas augšanas stāvokļiem, konkrētāk, spējas, kas ir būtiskas to spējai veidot ļaundabīgus audzējus. Šajos rakstos ( 1, 2 ), Bobs Veinbergs un es uzskaitījām to, ko mēs iedomājāmies kā kopīgās iezīmes, kas apvieno visu veidu vēža šūnas šūnu fenotipa līmenī. Mērķis bija nodrošināt konceptuālu sistēmu, kas ļautu racionalizēt dažādu cilvēka audzēju veidu un variantu sarežģītos fenotipus saistībā ar kopīgu pamatā esošo šūnu parametru kopumu. Sākotnēji mēs paredzējām sešu dažādu zīmola iespēju papildu iekļaušanu un vēlāk paplašinājām šo skaitu līdz astoņām.
Šo formulējumu ietekmēja atziņa, ka cilvēka vēzis attīstās kā daudzpakāpju procesu produkti un ka šo funkcionālo spēju iegūšanu kaut kādā veidā var saistīt ar atšķirīgiem audzēja patoģenēzes posmiem. Ļaundabīgo patoģenēzes daudzveidība, kas ietver vairākus audzēju veidus un arvien lielāku apakštipu pārpilnību, ietver dažādas novirzes (un tādējādi iegūtās spējas un īpašības), kas ir audu specifisku barjeru rezultāts, kas noteikti tiek apieti noteiktu audzēja veidošanās ceļu laikā. Lai gan mēs atzīstam, ka šādi specializēti mehānismi var būt noderīgi, mēs esam ierobežojuši pazīmju apzīmēšanu ar parametriem, kuriem ir plaša ietekme uz cilvēka vēža spektru.
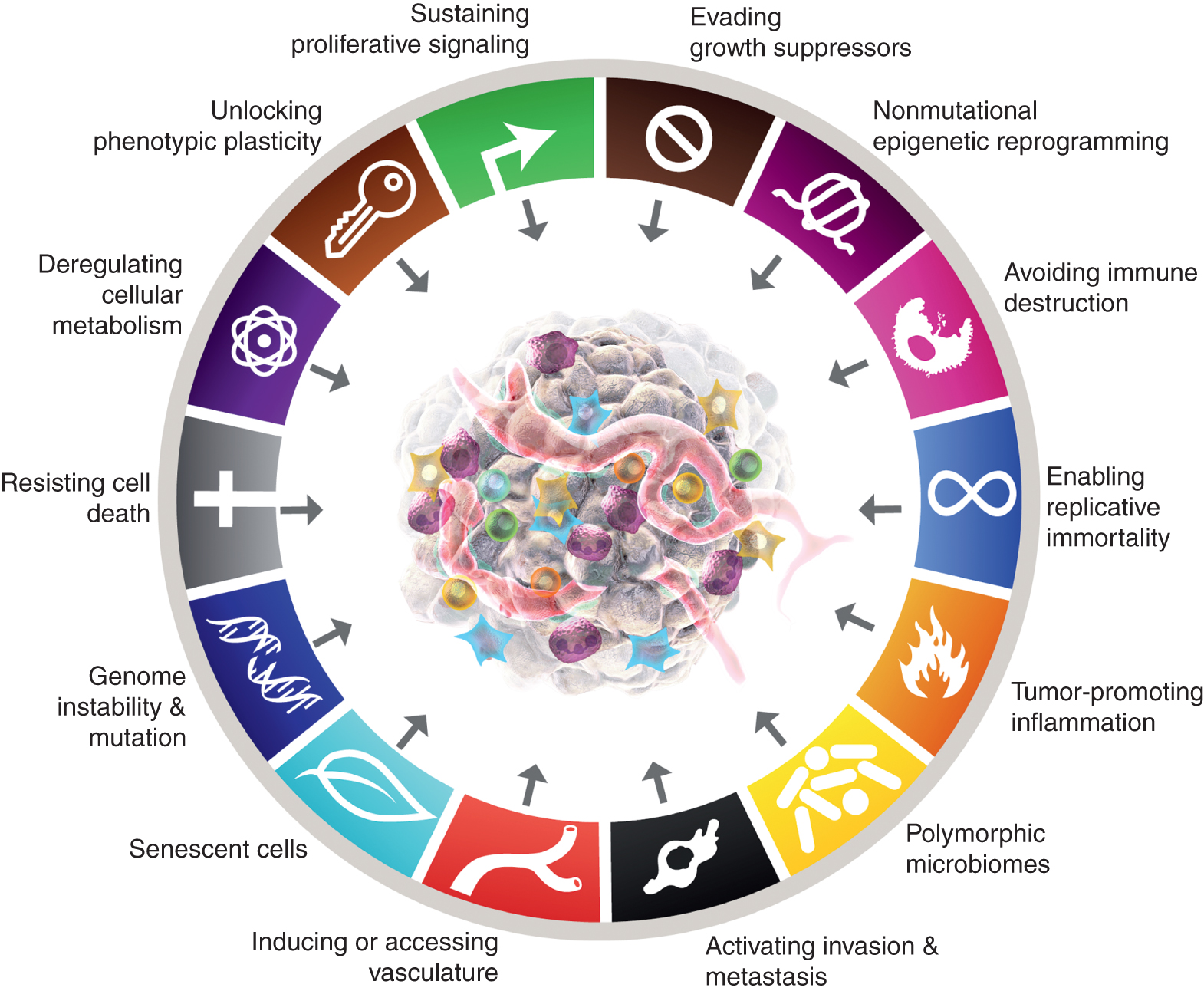
Astoņas pazīmes pašlaik ietver (1. att., pa kreisi) iegūtās spējas uzturēt proliferatīvus signālus, izvairīties no augšanas slāpētājiem, pretoties šūnu nāvei, nodrošināt replicatīvo nemirstību, izraisīt/piekļūt asinsvadiem, aktivizēt invāziju un metastāzes, pārprogrammēt šūnu metabolismu un izvairīties no imūnsistēmas iznīcināšanas. Jaunākajā šīs koncepcijas izstrādē (2) šūnu vielmaiņas regulējuma atcelšana un izvairīšanās no imūnsistēmas iznīcināšanas tika norobežotas kā “jaunās pazīmes”, taču tagad, vienpadsmit gadus vēlāk, ir skaidrs, ka, līdzīgi kā sākotnēji seši, tos var uzskatīt par galvenajām vēža pazīmēm un kā tādas ir iekļautas pašreizējā stāstījumā (1. att., pa kreisi).
1. attēls
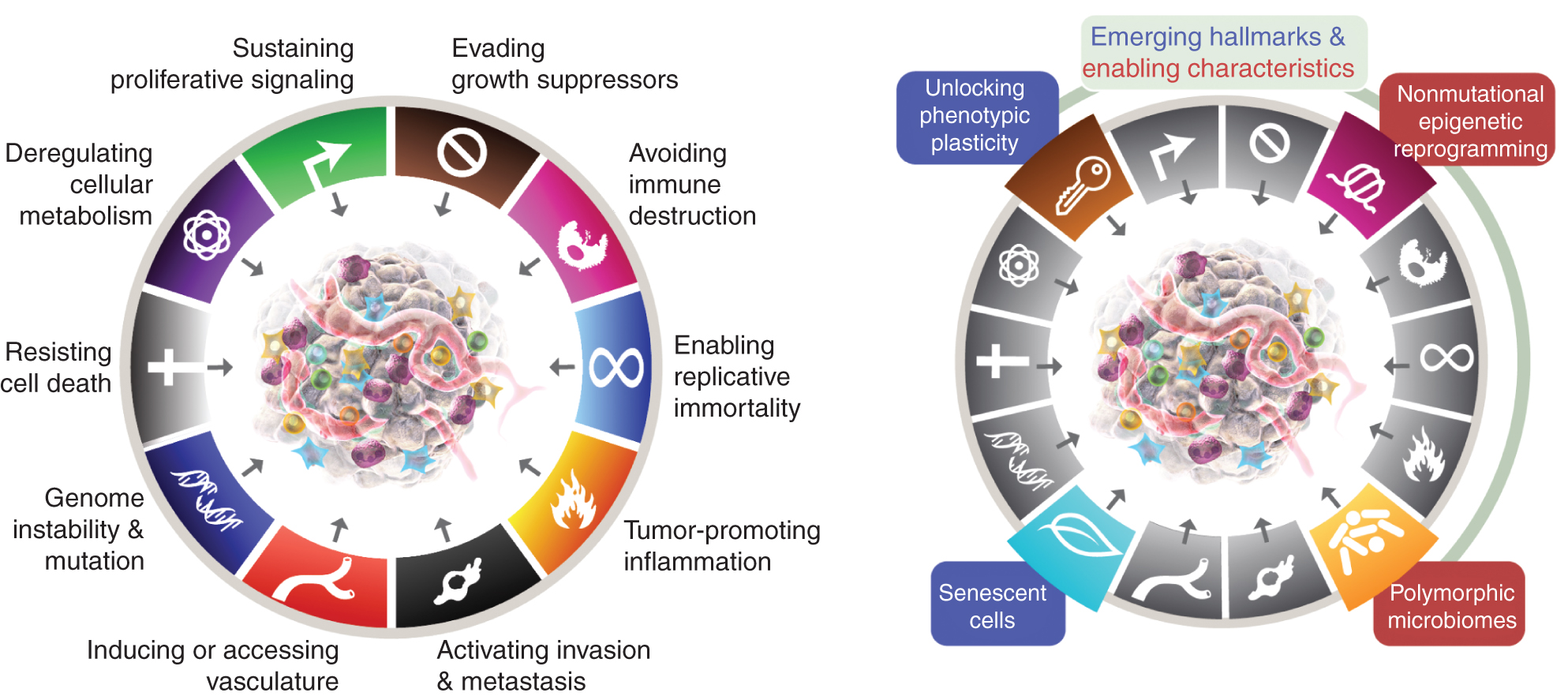
Vēža raksturīgās iezīmes pašlaik iemieso astoņas atšķirīgas spējas un divas atbalsta īpašības. Papildus sešām iegūtajām spējām — vēža pazīmēm —, kas tika ierosinātas 2000. gadā (1), divas sākotnējās 2011. gadā ieviestās "jaunās pazīmes" (2) — šūnu enerģētika (tagad biežāk saukta par "šūnu vielmaiņas pārprogrammēšanu") un "izvairīšanās no imūnsistēmas iznīcināšanas" - tika uzskatītas par pietiekami apstiprinātām.
Ņemot vērā arvien pieaugošo atziņu, ka audzējus var adekvāti vaskularizēt, vai nu ieslēdzot angioģenēzi, vai arī izvēloties normālu audu asinsvadu sistēmu (128), šī pazīme ir arī plašāk definēta kā spēja inducēt vai citādi piekļūt asinsvadu sistēmai, kas atbalsta audzēja augšanu galvenokārt ar invāzijas un metastāžu palīdzību.
2011. gada turpinājumā tika iekļauts arī “audzēju veicinošs iekaisums” kā otra pazīme, kas papildina visaptverošo “genoma nestabilitāti un mutāciju”, kas kopā bija būtiski iesaistītas astoņu parakstu (funkcionālo) spēju aktivizēšanā, kas nepieciešamas audzēja augšanai un progresēšanai. Tiesa, šajā pārskatā ir iekļautas papildu ierosinātās jaunas iezīmes un iespējotas funkcijas, tostarp "fenotipiskā plastiskuma atbloķēšana", "nemutācijas epiģenētiskā pārprogrammēšana", "polimorfie mikrobiomi" un "novecojošās šūnas". Vēža grafikas preču zīmes tika pārņemtas no Hanahan un Weinberg (2).
Kā mēs toreiz atzīmējām, šīs atšķirīgās iezīmes vien nevar risināt vēža patoģenēzes sarežģītību, t.i., h. precīzi molekulārie un šūnu mehānismi, kas ļauj attīstītajām preneoplastiskajām šūnām attīstīties un iegūt šīs novirzošās fenotipiskās spējas audzēja ģenēzes un ļaundabīgo audzēju progresēšanas gaitā.
Attiecīgi mēs esam pievienojuši vēl vienu jēdzienu diskusijai, kas tiek pasniegta kā “aktivizējošas pazīmes”, kas ir neoplazmas novirzes stāvokļa sekas, kas nodrošina līdzekļus, ar kuriem vēža šūnas un audzēji var iegūt šīs funkcionālās īpašības. Tādējādi veicinošās īpašības ir atspoguļotas molekulārajos un šūnu mehānismos, ar kuriem tiek iegūtas pazīmes, nevis pašās iepriekš minētajās astoņās prasmēs. Šie divi aktivācijas procesi bija genoma nestabilitāte un audzēju veicinošs iekaisums.
Mēs arī atzinām, ka audzēja mikrovide (TME), kas šeit definēta kā neviendabīga un interaktīvā vēža šūnu un vēža cilmes šūnu populācija, kā arī dažādi pieņemti stromas šūnu tipi - pārveidotā parenhīma un saistītā stroma - tagad tiek plaši novērtēta, jo tai ir būtiska loma audzēja veidošanā un ļaundabīgā progresēšanā.
Ņemot vērā pastāvīgo interesi par šiem formulējumiem un mūsu pastāvīgo nodomu veicināt pastāvīgu diskusiju un pazīmju shēmas pilnveidošanu, ir lietderīgi apsvērt bieži uzdoto jautājumu: vai šajā konceptuālajā modelī ir papildu iezīmes, kuras varētu iekļaut, ņemot vērā nepieciešamību to nodrošināt? ka tie ir plaši piemērojami visā cilvēku vēža spektrā? Attiecīgi es piedāvāju vairākas potenciālas jaunas pazīmes un veicinošas funkcijas, kuras ar laiku varētu tikt integrētas kā vēža konceptualizācijas pazīmju galvenās sastāvdaļas.
Šie parametri ir "fenotipiskā plastiskuma atbloķēšana", "nemutācijas epiģenētiskā pārprogrammēšana", "polimorfie mikrobiomi" un "novecojošās šūnas" (1. att., pa labi). Svarīgi ir tas, ka piemēri, kas sniegti šo tēžu pamatojumam, ir ilustratīvi, taču nekādā gadījumā nav visaptveroši, jo katru vinjeti atbalsta arvien vairāk un pārliecinošāk publicēto pierādījumu kopums.
Pieskaroties fenotipiskajai plastikai
Organoģenēzes laikā šūnu attīstība, noteikšana un organizēšana audos, lai veiktu homeostatiskās funkcijas, tiek papildināta ar terminālu diferenciāciju, un cilmes šūnas pārstāj augt, dažreiz neatgriezeniski, šiem procesiem sasniedzot kulmināciju. Tādējādi šūnu diferenciācijas galarezultāts vairumā gadījumu ir antiproliferatīvs, veidojot skaidru šķērsli neoplāzijai nepieciešamajai proliferācijai.
Arvien vairāk pierādījumu liecina, ka parasti ierobežotās fenotipiskās plastiskuma spējas, lai apietu terminālās diferenciācijas stāvokli vai izvairītos no tā, ir būtiska vēža patoģenēzes sastāvdaļa (3). Šī plastiskums var darboties vairākās izpausmēs (2. att.). Tādējādi topošās vēža šūnas, kuru izcelsme ir normāla šūna, kas ir attīstījusies pa ceļu, kas tuvojas vai pieņem pilnībā diferencētu stāvokli, var mainīt kursu, dediferencējot atpakaļ uz cilmes šūnu stāvokļiem.
Un otrādi, neoplastiskās šūnas, kas rodas no cilmes šūnas, kurām ir paredzēts sekot ceļam, kas noved pie terminālas diferenciācijas, var īssavienojumu procesu un uzturēt paplašinošās vēža šūnas daļēji diferencētā, priekštečiem līdzīgā stāvoklī. Alternatīvi, var notikt transdiferenciācija, kurā šūnas, kas sākotnēji bija iesaistītas vienā diferenciācijas ceļā, pāriet uz pilnīgi atšķirīgu attīstības programmu un tādējādi iegūst audiem specifiskas īpašības, kuras iepriekš nenoteica to parastās izcelsmes šūnas.
Šie piemēri apstiprina argumentu, ka dažādas šūnu plastiskuma formas atklāj fenotipisku plastiskumu. Kreisajā pusē fenotipiskā plastiskums, iespējams, ir iegūta raksturīga spēja, kas nodrošina dažādus šūnu diferenciācijas traucējumus, tostarp (i) diferenciāciju no nobriedušiem līdz cilmes stāvokļiem, (ii) apstādinātu (gala) diferenciāciju no cilmes šūnu stāvokļiem un (iii) transdiferenciāciju citās šūnu līnijās. Labajā pusē ir parādīti trīs ievērojami traucētas diferenciācijas veidi, kas ir neatņemami vēža patoģenēzē.
Atšķirīgi mainot cilmes šūnu normālu diferenciāciju par nobriedušām šūnām attīstības līnijās, tiek veicināta audzēja ģenēze un ļaundabīga progresēšana, kas rodas no izcelsmes šūnām šādos ceļos. Vēža grafikas preču zīmes tika pārņemtas no Hanahan un Weinberg (2).
2. attēls

Dediferenciācija
Resnās zarnas kanceroģenēze ir traucētas diferenciācijas piemērs, jo pastāv teleoloģiska vajadzība, lai iesācējušām vēža šūnām izbēgtu no terminālās diferenciācijas un atslāņošanās konveijera, kas principā varētu notikt, dediferencējot resnās zarnas epitēlija šūnas, kas vēl nav galīgi diferencējušās, vai apstājoties dažādu cilmes šūnu cilmes šūnu diferenciācijas rezultātā. Gan diferencētas šūnas, gan cilmes šūnas ir iesaistītas kā resnās zarnas vēža izcelsmes šūnas (4-6).
Divi attīstības transkripcijas faktori (TF), homeoboksa proteīns HOXA5 un SMAD4, kas ir iesaistīti BMP signalizācijā, ir ļoti izteikti diferencējošās resnās zarnas epitēlija šūnās un parasti tiek zaudēti progresējošās resnās zarnas karcinomās, kas raksturīgi ekspresē cilmes un cilmes šūnu marķierus. Funkcionālās perturbācijas peļu modeļos ir parādījuši, ka HOXA5 piespiedu ekspresija resnās zarnas vēža šūnās atjauno diferenciācijas marķierus, nomāc cilmes šūnu fenotipus un pasliktina invāziju un metastāzes, sniedzot pamatojumu tās raksturīgajai pazemināšanai (7, 8).
Turpretim SMAD4 panāk gan diferenciāciju, gan proliferācijas nomākšanu, ko izraisa onkogēna WNT signalizācija, ko atklāj SMAD4 ekspresijas inženierijas zudums, sniedzot skaidrojumu tās ekspresijas zudumam, lai nodrošinātu diferenciāciju un pēc tam WNT izraisītu hiperproliferāciju (5).
Proti, šo divu “diferenciācijas slāpētāju” zaudēšana ar no tā izrietošo diferenciāciju ir saistīta ar citu raksturīgo pazīmju spēju, kā arī citu raksturīgo pazīmju izraisošo regulatoru iegūšanu, kas sarežģī šīs pagaidu pazīmes stingro definīciju kā atdalāmu un neatkarīgu.
Vēl viena pierādījumu līnija attiecas uz melanocītu diferenciācijas galvenā regulatora MITF nomākto ekspresiju, kas, šķiet, ir iesaistīts ļaundabīgas melanomas agresīvu formu ģenēzē. Šīs attīstības TF zudums ir saistīts ar neironu ceku priekšteču gēnu reaktivāciju un gēnu, kas raksturo pilnībā diferencētus melanocītus, pazemināšanos. Neironu ceku gēnu atkārtota parādīšanās norāda, ka šīs šūnas atgriežas cilmes stāvoklī, no kura attīstās melanocīti.
Turklāt BRAF izraisītu melanomu ciltsrakstu izsekošanas pētījumā tika konstatēti nobrieduši pigmentēti melanocīti kā izcelsmes šūnas, kuras audzēja ģenēzes laikā tiek diferencētas (9). Proti, mutants BRAF onkogēns, kas atrodams vairāk nekā pusē ādas melanomu, izraisa hiperproliferāciju, kas notiek pirms un tāpēc var tikt mehāniski atdalīta no turpmākās diferenciācijas, kas rodas no MITF pazeminātas regulēšanas.
Cits pētījums funkcionāli ietekmēja attīstības TF ATF2 augšupregulāciju, kuras raksturīgā ekspresija peles un cilvēka melanomās netieši nomāc MITF1, vienlaikus ar ļaundabīgu progresēšanu attiecīgi dediferencētās melanomas šūnās (10). Un otrādi, ATF2 mutantu formu melanomās, kas nevar nomākt MITF, rodas labi diferencētas melanomas (11).
Turklāt nesen veikts pētījums (12) ir saistījis ciltsrakstu diferenciāciju ar aizkuņģa dziedzera saliņu šūnu audzēju ļaundabīgu progresēšanu ar metastāzēm pakļautām karcinomām; šīs neiroendokrīnās šūnas un atvasinātie audzēji rodas no attīstības līnijas, kas atšķiras no tās, kas rada daudz lielāku skaitu blakus esošo šūnu, kas veido eksokrīno un aizkuņģa dziedzeri, un no tā izrietošās ductal adenokarcinomas.
Jāatzīmē, ka ir rūpīgi raksturots daudzpakāpju diferenciācijas ceļš no saliņu cilmes šūnām līdz nobriedušām β-šūnām (13). Salīdzinošā transkripta profilēšana liecina, ka adenomai līdzīgie saliņu audzēji ir vislīdzīgākie nenobriedušām, bet diferencētām insulīnu ražojošām β-šūnām, savukārt invazīvās karcinomas ir vislīdzīgākās embrionālo saliņu šūnu prekursoriem. Progresēšana uz slikti diferencētām karcinomām ietver sākotnējo diferenciācijas posmu, kas sākotnēji neietver palielinātu proliferāciju vai samazinātu apoptozi salīdzinājumā ar labi diferencētām adenomām, kuras abas mēdz rasties vēlāk.
Tādējādi diskrēto diferenciācijas soli neizraisa novērojamas izmaiņas ilgstošas proliferācijas un rezistences pret apoptozi raksturīgajās pazīmēs. Drīzāk miRNS regulēšana, kas iepriekš bija saistīta ar saliņu cilmes stāvokļa noteikšanu, ir tāda, kas tiek samazināta β-šūnu terminālās diferenciācijas laikā, 12.
Bloķēta diferenciācija
Lai gan iepriekš minētie piemēri ilustrē, kā diferenciācijas faktora ekspresijas nomākšana var veicināt audzēja veidošanos, ļaujot labāk diferencētām šūnām dediferencēties par priekštečiem, citos gadījumos nepilnīgi diferencētās cilmes šūnas var ciest no regulējošām izmaiņām, kas aktīvi bloķē to tālāku progresēšanu pilnībā diferencētos, parasti neproliferatīvos stāvokļos.
Jau sen ir dokumentēts, ka akūta promielocīta leikēmija (APL) rodas hromosomu translokācijas rezultātā, kas savieno PML lokusu ar gēnu, kas kodē retinoīnskābes α kodolreceptoru (RARα). Mieloīdās cilmes šūnas, kas veic šādas translokācijas, acīmredzot nespēj turpināt savu parasto terminālo diferenciāciju granulocītos, kā rezultātā šūnas tiek iesprostotas proliferatīvā, promielocītu līdzīgā cilmes stadijā (14).
Šīs shēmas koncepcijas pierādījums ir iegūts, ārstējot kultivētas APL šūnas, slimības peles modeļus un skartos pacientus ar retinīnskābi, RARα ligandu; Šī terapeitiskā ārstēšana liek neoplastiskajām APL šūnām diferencēties šķietami nobriedušos, neproliferējošos granulocītos, tādējādi īssavienojot to progresīvo proliferācijas paplašināšanos (14–16).
Šīs tēmas variants attiecas uz citu akūtas mieloleikozes formu, kas satur t (8; 21) translokāciju, kas rada AML1-ETO saplūšanas proteīnu. Šis proteīns vien var pārveidot mieloīdu priekštečus, vismaz daļēji bloķējot to diferenciāciju. Terapeitiskā iejaukšanās peļu modeļos un pacientiem ar hromatīnu modificējošās histona deacetilāzes (HDAC) farmakoloģisko inhibitoru izraisa mieloleikozes šūnu atsākšanu diferenciācijā šūnās ar nobriedušāku mieloīdo šūnu morfoloģiju. Šo reakciju pavada proliferācijas spējas samazināšanās, tādējādi pasliktinot šīs leikēmijas progresēšanu (17, 18).
Trešais melanomas piemērs ir attīstības TF, SOX10, kas parasti tiek samazināts melanocītu diferenciācijas laikā. Funkcijas palielināšanas un zaudēšanas pētījumi BRAF izraisītu melanomu zebrafish modelī ir parādījuši, ka neparasti uzturēta SOX10 ekspresija bloķē neironu cilmes šūnu diferenciāciju melanocītos, ļaujot veidot BRAF izraisītas melanomas (19).
Citi diferenciācijas modulatoru piemēri ir metabolīts alfa-ketoglutarāts (αKG), kas ir nepieciešams kofaktors vairākiem hromatīnu modificējošiem enzīmiem, kas, kā pierādīts, ir iesaistīti noteiktu diferencētu šūnu stāvokļu stimulēšanā. Aizkuņģa dziedzera vēža gadījumā audzēja nomācējs p53 stimulē αKG veidošanos un diferencētāka šūnu stāvokļa uzturēšanu, savukārt prototipisks p53 funkcijas zudums izraisa αKG līmeņa samazināšanos un no tā izrietošo diferenciāciju, kas ir saistīta ar ļaundabīga audzēja progresēšanu (20).
Vienā no aknu vēža formām izocitrāta dehidrogenāzes gēna (IDH1/2) mutācija neizraisa diferenciāciju izraisoša αKG veidošanos, bet drīzāk radniecīgu “onkometabolītu”, D-2-hidroksigluterātu (D2HG), kas, kā ir pierādīts, bloķē hepatocītu diferenciāciju aknu cilmes šūnu cilmes šūnās, izmantojot galveno represoru D2H. diferenciācija un klusums, HNF4a.
D2HG izraisīta HNF4a funkcijas nomākšana izraisa hepatocītu cilmes šūnu proliferatīvu ekspansiju aknās, kas kļūst uzņēmīgas pret onkogēnām transformācijām pēc tam sekojošas KRAS onkogēna mutācijas aktivācijas, kas izraisa ļaundabīgu progresēšanu līdz aknu holangiokarcinomai (21). IDH1/2 mutants un tā onkometabolīts D2HG darbojas arī dažādos mieloīdos un citos cietos audzēju veidos, kur D2HG inhibē no αKG atkarīgās dioksigenāzes, kas nepieciešamas histonu un DNS metilēšanas notikumiem, kas veicina hromatīna struktūras izmaiņas attīstības līnijas diferenciācijas laikā, tādējādi iesaldējot vēža šūnu rašanos (2, cilmes 2. cilmes šūnas).
Papildu, saistīta koncepcija ir “apieta diferenciācija”, kurā daļēji vai nediferencētas cilmes šūnas iziet no šūnu cikla un atrodas aizsargājošās nišās ar potenciālu atjaunot proliferācijas paplašināšanos (24), lai gan joprojām pastāv selektīvs spiediens, lai vienā vai otrā veidā izjauktu ieprogrammēto diferenciāciju.
Transdiferenciācija
Patologi jau sen ir atzinuši transdiferenciācijas jēdzienu audu metaplāzijas veidā, kurā noteikta diferencēta fenotipa šūnas ievērojami maina savu morfoloģiju, lai kļūtu skaidri atpazīstamas kā cita audu elementi, kuras spilgts piemērs ir Bareta barības vads, kur hronisks slāņveida plakanšūnu epitēlija iekaisums inducē vienkāršu esdiphagus kolonnas transmisiju. zarnās, tādējādi veicinot turpmāku adenokarcinomu attīstību, nevis plakanšūnu karcinomas, kas sagaidāmas no šī plakanšūnu epitēlija (3).
Tagad molekulārie determinanti atklāj dažādu vēža veidu transdiferenciācijas mehānismus gan gadījumos, kad rupja audu metaplāzija ir acīmredzama, gan citos gadījumos, kad tā ir nedaudz smalkāka, kā ilustrē šādi piemēri.
Informatīvs transdiferenciācijas gadījums kā diskrēts audzēja ģenēzes notikums attiecas uz aizkuņģa dziedzera ductal adenokarcinomu (PDAC), kurā viena no iesaistītajām izcelsmes šūnām, aizkuņģa dziedzera acinārā šūna, var pārveidoties par ductal šūnu fenotipu neoplastiskas attīstības uzsākšanas laikā. Divi TF — PTF1a un MIST1 — kontrolē aizkuņģa dziedzera diferencēto acināro šūnu stāvokļa specifikāciju un uzturēšanu, izmantojot to izpausmi pašpietiekamu "uz priekšu" regulējošo cilpu kontekstā (25).
Abi šie TF bieži tiek samazināti neoplastiskās attīstības un cilvēka un peles PDAC ļaundabīgās progresēšanas laikā. Funkcionālie ģenētiskie pētījumi ar pelēm un kultivētām cilvēka PDAC šūnām ir parādījuši, ka eksperimentāli piespiedu PTF1a ekspresija pasliktina KRAS izraisītu transdiferenciāciju un proliferāciju, kā arī var piespiest jau audzēju šūnu rediferenciāciju mierīgā acinārā šūnu fenotipā (26).
Un otrādi, PTF1a ekspresijas nomākšana izraisa acināra-vada metaplāziju, proti, transdiferenciāciju, un tādējādi sensibilizē kanāla veida šūnas pret onkogēnu KRAS transformāciju, paātrinot turpmāko invazīvās PDAC attīstību (27). Tāpat MIST1 piespiedu ekspresija KRAS ekspresējošā aizkuņģa dziedzerī arī bloķē transdiferenciāciju un pasliktina aizkuņģa dziedzera audzēja ģenēzes sākšanos, ko citādi veicina premalignant duct-like (PanIN) bojājumu veidošanās, savukārt MIST1 ģenētiskā dzēšana pastiprina to veidošanos un neoplastisko virzību (28).
PTF1 vai MIST1 ekspresijas zudums audzēja ģenēzes laikā ir saistīts ar cita attīstības regulējošā TF, SOX9, pastiprinātu ekspresiju, kas parasti ir efektīva kanāla šūnu specifikācijā (27, 28). Ir pierādīts, ka SOX9 piespiedu regulēšana, tādējādi izvairoties no nepieciešamības samazināt PTF1a un MIST1, stimulē acināro šūnu transdiferenciāciju kanāla šūnu fenotipā, kas ir jutīgs pret KRAS izraisītu neoplāziju (29), kas nozīmē, ka SOX9 ir galvenais funkcionālais efekts to cilvēka PDAC pazemināšanai gēnās.
Tādējādi trīs TF, kas regulē aizkuņģa dziedzera diferenciāciju, var mainīt dažādos veidos, lai izraisītu transdiferencētu stāvokli, kas KRAS mutācijas aktivācijas kontekstā atvieglo onkogēnu transformāciju un audzēja ģenēzes un ļaundabīgas progresēšanas sākšanos.
Papildu ar hromatīnu saistīto regulējošo faktoru SOX saimes locekļi, no vienas puses, lielā mērā ir saistīti gan ar šūnu likteņa specifikāciju, gan ar līnijas maiņu attīstībā (30), un, no otras puses, ar vairākiem ar audzēju saistītiem fenotipiem (31). Vēl viens ievērojams SOX izraisītas transdiferenciācijas piemērs ietver terapeitiskās rezistences mehānismu prostatas vēža gadījumā.
Šajā gadījumā RB un p53 audzēju nomācēju zudums, kuru trūkums ir raksturīgs neiroendokrīnajiem audzējiem, ir nepieciešams, bet nav pietiekams, lai labi diferencētas prostatas vēža šūnas pārveidotos par karcinomas šūnām, kuras ir iekļuvušas diferenciācijas līnijā ar molekulārajām un histoloģiskām iezīmēm, kas neizpauž neiroendokrīno un specifisko receptoru šūnas. Papildus RB un p53 zudumam iegūtajai rezistencei pret antiandrogēnu terapiju ir nepieciešama SOX2, attīstību regulējošā gēna, ekspresija, kas, kā pierādīts, palīdz izraisīt terapiju reaģējošo adenokarcinomas šūnu transdiferenciāciju atvasinājumos, kas atrodas neiroendokrīno šūnu stāvoklī, kas nav izturīgs pret terapiju (32).
Trešais piemērs parāda arī transdiferenciāciju kā stratēģiju, ko izmanto karcinomas šūnas, lai izvairītos no izvadīšanas ar ciltsrakstu specifisku terapiju, šajā gadījumā ar ādas bazālo šūnu karcinomām (BCC), kas apstrādātas ar eža nogludināta (HH/SMO) onkogēnā ceļa farmakoloģisku inhibitoru, kas, kā zināms, veicina šo šūnu neoplastisko augšanu (33).
Pret narkotikām izturīgas vēža šūnas pāriet uz ar attīstību saistītu, bet atšķirīgu šūnu tipu, izmantojot plašas epiģenētiskas izmaiņas specifiskos hromatīna domēnos un izmainītu divu superpastiprinātāju pieejamību. Jauniegūtais BCC šūnu fenotipiskais stāvoklis ļauj tām saglabāt onkogēnā WNT signalizācijas ceļa ekspresiju, kas savukārt nodrošina neatkarību no narkotiku nomāktā HH / SMO signalizācijas ceļa (34).
Kā sagaidāms no šīs transdiferenciācijas, vēža šūnu transkripts pāriet no gēna paraksta, kas atspoguļo iesaistīto BCC izcelsmes šūnu, proti, matu folikulu izspiedušās cilmes šūnas, uz parakstu, kas norāda uz bazālajām cilmes šūnām, kas apdzīvo BCC starpfolikulu epidermu. Šāda transdiferenciācija, lai nodrošinātu zāļu rezistenci, arvien vairāk tiek dokumentēta dažādos vēža veidos (35).
Šķiet, ka attīstības līnijas plastiskums ir izplatīts arī galvenajos plaušu karcinomas apakštipos, t.i., h. neiroendokrīnās karcinomās [sīkšūnu plaušu vēzis (SCLC)] un adenokarcinomas + plakanšūnu karcinomas [kolektīvs nesīkšūnu plaušu vēzis (NSCLC)]. Vienšūnu RNS sekvencēšana ir atklājusi ārkārtīgi dinamisku un neviendabīgu konversiju starp šiem apakštipiem, kā arī izteiktas variācijas tajās plaušu audzēja ģenēzes, sekojošas ļaundabīgas progresēšanas un atbildes reakcijas uz terapiju stadijās (36-38).
Tāpēc, nevis vienkārša tīras klonālas pārejas no vienas līnijas uz citu konceptualizēšana, šie pētījumi sniedz daudz sarežģītāku priekšstatu par dinamiski savstarpēji konvertējošām vēža šūnu apakšpopulācijām, kurām ir vairāku attīstības līniju un diferenciācijas stadiju iezīmes, kas šajā ziņā ir prātīgs ieskats cilvēka plaušu vēža terapeitiskajā mērķtiecībā uz ciltsrakstu. Sāk identificēt šīs dinamiskās fenotipiskās plastiskuma regulējošos faktorus (37, 39, 40).
Kopsavilkums
Trīs iepriekš aprakstītās mehānismu klases izceļ selektīvos šūnu plastiskuma regulatorus, kas vismaz daļēji ir atdalāmi no galvenajiem onkogēnajiem faktoriem un citām atšķirīgajām iespējām. Papildus šiem piemēriem ir daudz pierādījumu, kas saista daudzas vēža formas ar traucētu diferenciāciju, ko papildina transkripta parakstu un citu fenotipu iegūšana, piemēram, histoloģiskā morfoloģija, kas ir saistīti ar cilmes šūnu vai cilmes šūnu stadijām, kas novērotas attiecīgajos normālos audos. izcelsmes vai citos attālāk saistītos šūnu tipos un līnijās (41-43).
Šīs trīs fenotipiskās plastiskuma apakšklases — nobriedušu šūnu diferenciācija atpakaļ uz priekšteču stāvokļiem, apstājusies diferenciācija, lai iesaldētu jaunattīstības šūnas cilmes/cilmes šūnu stāvokļos, un transdiferenciācija uz alternatīvām šūnu līnijām — šķiet efektīvas vairākos vēža veidos primārās audzēja ģenēzes, ļaundabīgas atbildes reakcijas uz terapiju laikā un/vai.
Tomēr ir divi konceptuāli apsvērumi. Pirmkārt, dediferenciācija un apstājusies diferenciācija, iespējams, ir savstarpēji saistītas, jo tās nav atšķiramas daudzos audzēju veidos, kuros izcelsmes šūna - diferencēta šūna vai cilmes šūna - nav zināma vai alternatīvi iesaistīta. Otrkārt, cilmes šūnu fenotipu iegūšana vai uzturēšana un diferencētu pazīmju zaudēšana vairumā gadījumu ir neprecīzs normālas attīstības stadijas atspoguļojums, iegremdējot vēža šūnā citu raksturīgu izmaiņu vidē, kuras nav sastopamas dabiski jaunattīstības šūnās.
Turklāt cita fenotipiskā plastiskuma forma ir saistīta ar šūnu novecošanos, kas plašāk apspriesta turpmāk, kā rezultātā vēža šūnas, kas izraisa šķietami neatgriezenisku novecošanos, spēj izbēgt un turpināt proliferatīvo paplašināšanos (44). Visbeidzot, tāpat kā citas atšķirīgas spējas, šūnu plastiskums nav jauns izgudrojums vai vēža šūnu aberācija, bet gan latento, bet aktivizējamo spēju bojājums, ko dažādas normālas šūnas izmanto, lai atbalstītu homeostāzi, remontu un reģenerāciju (45).
Kopumā šie ilustratīvie piemēri mudina apsvērt, ka šūnu plastiskuma atbloķēšana, lai iespējotu dažādas traucētas diferenciācijas formas, atspoguļo atšķirīgu spēju, kas regulējumā un šūnu fenotipā atšķiras no labi apstiprinātajām vēža galvenajām pazīmēm (2. attēls).
Epiģenētiskā pārprogrammēšana bez mutācijas
Genoma (DNS) nestabilitātes un mutācijas īpašība ir būtiska vēža attīstības un patoģenēzes sastāvdaļa. Pašlaik vairāki starptautiski konsorciji kataloģizē mutācijas visā cilvēka vēža šūnu genomā, praktiski visos cilvēka vēža veidos, dažādos ļaundabīgo audzēju progresēšanas posmos, tostarp metastātiskos bojājumus, un adaptīvās terapijas rezistences attīstības laikā. Viens no rezultātiem ir tagad plaši izplatītā atziņa, ka mutācijas gēnos, kas organizē, modulē un uztur hromatīna arhitektūru un tādējādi regulē gēnu ekspresiju visā pasaulē, arvien vairāk tiek atklātas un funkcionāli saistītas ar vēža pazīmēm (46-48).
Turklāt ir argumenti citai šķietami neatkarīgai genoma pārprogrammēšanas formai, kas ietver tīri epiģenētiski regulētas izmaiņas gēnu ekspresijā, ko varētu saukt par "nemutācijas epiģenētisko pārprogrammēšanu" (3. att.). Faktiski tēze par vēža evolūciju bez mutācijām un raksturīgu vēža fenotipu tīri epiģenētisku programmēšanu tika izvirzīta gandrīz pirms desmit gadiem (49), un tā tiek apspriesta arvien vairāk (46, 50-52).
3. attēls

Līdzīgi tam, kas notiek embrioģenēzes un audu diferenciācijas un homeostāzes laikā, uzkrājošie pierādījumi liecina, ka instrumentālās gēnu regulēšanas shēmas un tīklus audzējos var kontrolēt ar daudziem bojātiem un kopīgi izvēlētiem mehānismiem, kas ir neatkarīgi no genoma nestabilitātes un gēnu mutācijas. Vēža grafikas preču zīmes tika pārņemtas no Hanahan un Weinberg (2).
Protams, gēnu ekspresijas nemutācijas epiģenētiskās regulēšanas jēdziens ir labi izveidots kā centrālais mehānisms, kas veicina embriju attīstību, diferenciāciju un organoģenēzi (53-55). Piemēram, pieaugušajam ilgtermiņa atmiņa ietver izmaiņas gēnu un histonu modifikācijās, hromatīna struktūrā un gēnu ekspresijas slēdžu iedarbināšanā, ko laika gaitā stabili uztur pozitīvas un negatīvas atgriezeniskās saites cilpas (56, 57). Arvien vairāk pierādījumu apstiprina domu, ka analogas epiģenētiskas izmaiņas var veicināt raksturīgo spēju iegūšanu audzēja attīstības un ļaundabīgas progresēšanas laikā. Lai atbalstītu šo hipotēzi, tālāk ir sniegti daži piemēri.
Epiģenētiskās pārprogrammēšanas mikrovides mehānismi
Ja ne tikai ar onkogēnām mutācijām, kā tiek pārprogrammēts vēža šūnu genoms? Arvien vairāk pierādījumu liecina, ka audzēja mikrovides novirzošās fizikālās īpašības var izraisīt plašas izmaiņas epigenomā, no kurām izmaiņas, kas ir labvēlīgas īpašību spēju fenotipiskajai atlasei, var izraisīt vēža šūnu klonu izaugšanu ar uzlabotu piemērotību proliferatīvai paplašināšanai.
Bieža audzēju (vai audzēju reģionu) pazīme ir hipoksija nepietiekamas vaskularizācijas rezultātā. Hipoksija, piemēram, samazina TET demetilāžu aktivitāti, izraisot būtiskas izmaiņas metilomā, īpaši hipermetilāciju (58). Nepietiekama vaskularizācija, visticamāk, ierobežos arī kritisko ar asinīm pārnēsāto uzturvielu biopieejamību, un, piemēram, ir pierādīts, ka barības vielu atņemšana maina translācijas kontroli un attiecīgi palielina krūts vēža šūnu ļaundabīgo fenotipu (59).
Pārliecinošs hipoksijas izraisītas epiģenētiskās regulēšanas piemērs ir nemainīgi letālas bērnu ependimomas forma. Tāpat kā daudziem embrionāliem un bērnu audzējiem, šai formai trūkst atkārtotu mutāciju, jo īpaši onkogēnu un audzēju nomācēju vadītāju mutāciju trūkums. Drīzāk ir pierādīts, ka šo vēža šūnu patoloģiska augšana tiek kontrolēta ar hipoksijas izraisītu gēnu regulēšanas programmu (60, 61). Jāatzīmē, ka šī vēža iespējamā izcelsmes šūna atrodas hipoksiskā nodalījumā un, iespējams, sensibilizē tajā esošās šūnas, lai ierosinātu audzēja veidošanos, izmantojot vēl nezināmus kofaktorus.
Vēl viens pārliecinošs pierādījums par mikrovides izraisītu epiģenētisko regulējumu attiecas uz vēža šūnu invazīvās augšanas spēju. Klasisks piemērs ir atgriezeniska vēža šūnu invazivitātes indukcija daudzu cieto audzēju malās, ko organizē attīstības regulēšanas programma, kas pazīstama kā pāreja no epitēlija uz mezenhimālu (EMT; atsauces 62–64). Proti, nesen tika pierādīts, ka galvenais EMT regulators ZEB1 inducē histona metiltransferāzes SETD1B ekspresiju, kas savukārt uztur ZEB1 ekspresiju pozitīvas atgriezeniskās saites cilpā, kas uztur EMT (invazīvo) regulējošo stāvokli (65).
Iepriekšējā pētījumā līdzīgi tika dokumentēts, ka EMT indukcija, palielinot saistītā TF, SNAIL1, ekspresiju, izraisīja ievērojamas izmaiņas hromatīna ainavā vairāku hromatīna modifikatoru indukcijas rezultātā, kuru darbība tika pierādīta kā nepieciešama fenotipiskā stāvokļa uzturēšanai (66). Turklāt vairāki apstākļi un faktori, ar kuriem saskaras vēža šūnas audzēju malās, tostarp hipoksija un stromas šūnu izdalītie citokīni, acīmredzot var izraisīt EMT un tādējādi invazivitāti (67, 68).
Spilgts mikrovides invazivitātes programmēšanas piemērs, kas it kā nav saistīts ar EMT programmu, ietver neironu signalizācijas ķēdes autokrīno aktivizēšanu, kas ietver izdalīto glutamātu un tā receptoru NMDAR (69, 70). Jāatzīmē, ka daudzu cieto audzēju prototipiskajam stīvumam, ko iemieso plašās ekstracelulārās matricas (ECM) izmaiņas, kas aptver tajās esošās šūnas, ir liela ietekme uz vēža šūnu invazīvām un citām fenotipiskām īpašībām.
Salīdzinājumā ar parasto audu ECM, no kura rodas audzēji, audzēja ECM parasti raksturo palielināta šķērssaistība un blīvums, fermentatīvās modifikācijas un mainīts molekulārais sastāvs, kas kolektīvi, daļēji caur integrīna receptoriem ECM motīviem, stīvuma izraisītu signālu un gēnu ekspresijas tīkliem, kas izraisa invazivitāti (7 un citas raksturīgas pazīmes).
Papildus šādiem regulējošiem mehānismiem, ko nodrošina fiziskā audzēja mikrovide, parakrīnā signalizācija, kas ietver šķīstošus faktorus, ko ekstracelulārajā vidē izdala dažādi šūnu tipi, kas apdzīvo cietos audzējus, var arī veicināt vairāku morfoloģiski atšķirīgu invazīvu augšanas programmu ierosināšanu (72), no kurām tikai viena tiek saukta par "virs-mezenhimālo epidēmisko regulējumu". EMT mehānisms.
Epiģenētiskā regulējošā neviendabība
Pieaugošā zināšanu bāze palielina izpratni par intratumorālās neviendabības nozīmi fenotipiskās daudzveidības veidošanā, kur proliferatīvai paplašināšanai un invāzijai vispiemērotākās šūnas pārspēj savus brāļus un tāpēc tiek atlasītas ļaundabīgai progresēšanai. Protams, viens no šīs fenotipiskās neviendabības aspektiem ir saistīts ar hronisku vai epizodisku genoma nestabilitāti un no tā izrietošo ģenētisko neviendabīgumu šūnās, kas apdzīvo audzēju.
Turklāt kļūst arvien skaidrāks, ka var pastāvēt epiģenētiska neviendabība, kas nav balstīta uz mutācijām. Spilgts piemērs ir linkera histons H1.0, kas tiek dinamiski ekspresēts un represēts vēža šūnu apakšpopulācijās dažādu audzēju veidu diapazonā, ar sekojošu megabāzes lieluma domēnu sekvestrāciju vai pieejamību [73]. Proti, tika konstatēts, ka vēža šūnu populācijai ar represētu H1.0 ir cilmes līdzīgas īpašības, uzlabota audzēja ierosināšanas spēja un saistība ar sliktu prognozi pacientiem.
Vēl viens epiģenētiski regulētas plastiskuma piemērs ir aprakstīts cilvēka mutes plakanšūnu karcinomās (SCC), kur vēža šūnas invazīvās malās pieņem daļēju EMT stāvokli (p-EMT), kam trūkst iepriekšminēto mezenhimālo TF, bet ekspresē citus EMT definējošus gēnus, kas nav izteikti audzēju centrālajā kodolā (74).
Acīmredzot p-EMT šūnas neatspoguļo mutāciju izmainīto šūnu klonālo sadalījumu: primāro audzēju vēža šūnu kultūras satur gan p-EMT hi, gan p-EMT lo šūnu dinamiskus maisījumus un, kad p-EMT hi/lo šūnas tika attīrītas un kultivētas FACS, abas atgriezās jauktās p-EMT hi un p-EMT lo populācijās 4 dienu laikā. Lai gan parakrīnos signālus no blakus esošās stromas var uzskatīt par deterministiskiem p-EMT hi stāvoklim, abu epiģenētisko stāvokļu stabila klātbūtne un reģenerācija kultūrā liecina par vēža šūnām raksturīgu mehānismu. Proti, šo secinājumu apstiprina 198 šūnu līniju analīze, kas pārstāv 22 vēža veidus, tostarp SCC, kur šūnu līniju modeļos, kā arī ar tiem saistītajos primārajos audzējos tika dažādi atklāti 12 stabili neviendabīgi epiģenētiski stāvokļi (ieskaitot p-EMT SCC) (75).
Atkal, neviendabīgos fenotipiskos stāvokļus nevarēja saistīt ar nosakāmām ģenētiskām atšķirībām, un vairākos gadījumos ir pierādīts, ka konkrēta stāvokļa FACS šķirotas šūnas dinamiski līdzsvarojas pēc kultūras, apkopojot stabilu līdzsvaru starp neviendabīgajiem stāvokļiem, kas novēroti sākotnējās šūnu līnijās.
Turklāt dažādu atribūtu genoma mēroga profilēšanas tehnoloģijas — ārpus DNS sekvences un tās mutācijas variācijas — izgaismo ietekmīgus vēža šūnu genoma anotācijas un organizācijas elementus, kas korelē ar pacienta prognozi un arvien vairāk ar raksturīgajām spējām (76–78). Epigenomisko neviendabīgumu atklāj arvien jaudīgākas tehnoloģijas genoma mēroga DNS metilēšanas (79, 80), histonu modifikācijas (81), hromatīna pieejamības (82) un RNS pēctranskripcijas modifikācijas un translācijas profilēšanai (83, 84).
Izaicinājums attiecībā uz šeit aplūkoto postulātu būs noteikt, kurām epigenomiskajām modifikācijām dažos vēža veidos (i) ir regulējoša nozīme un (ii) tās raksturo tīri nemutācijas pārprogrammēšanu pretstatā mutāciju izraisītai un tādējādi genoma izskaidrojamai nestabilitātei.
Stromas šūnu tipu epiģenētiskā regulēšana, kas apdzīvo audzēja mikrovidi
Kopumā netiek uzskatīts, ka palīgšūnas audzēja mikrovidē, kas funkcionāli veicina raksturīgo spēju iegūšanu, cieš no ģenētiskas nestabilitātes un mutāciju pārprogrammēšanas, lai uzlabotu to audzēju veicinošās aktivitātes; drīzāk tiek secināts, ka šīs šūnas - ar vēzi saistītie fibroblasti, iedzimtas imūnās šūnas un audzēja asinsvadu endotēlija šūnas un pericīti - tiek epiģenētiski pārprogrammētas pēc to vervēšanas ar šķīstošiem un fizikāliem faktoriem, kas nosaka cietā audzēja mikrovidi (2, 85).
Paredzams, ka pašlaik vēža šūnām izmantotās multi-omic profilēšanas tehnoloģijas arvien vairāk tiks izmantotas, lai pētītu papildu (stromas) šūnas audzējos, lai noskaidrotu, kā tiek bojātas normālas šūnas, lai funkcionāli atbalstītu audzēja attīstību un progresēšanu. Piemēram, nesen veikts pētījums (86) liecina, ka šāda pārprogrammēšana var ietvert epigenoma modifikācijas papildus citokīnu, kemokīnu un augšanas faktoru induktīvai apmaiņai, kas maina intracelulāros signālu tīklus visos šajos šūnu veidos:
Kad peļu modeļus ar metastāzēm plaušās apstrādāja ar DNS metiltransferāzes inhibitora (5-azacitidīna) un histona modifikācijas inhibitora (HDAC) kombināciju, tika konstatēts, ka infiltrējošās mieloīdās šūnas no nenobrieduša (audzēju veicinoša) cilmes stāvokļa ir pārgājušas šūnās, kas atgādina nobriedušu intersticiālu (audzēju neagonizējošo, ne-audzēju agonistu). audzēji, nespēja atbalstīt tipiskās spējas, kas nepieciešamas efektīvai metastātiskajai kolonizācijai (86). Ir iedomājams, ka multi-omic profilēšana un farmakoloģiskas perturbācijas palīdzēs noskaidrot pārprogrammēto epiģenētisko stāvokli šādās mieloīdās šūnās, kā arī citos raksturīgos palīgšūnu tipos, kas apdzīvo audzēja mikrovidi.
Kopsavilkums
Kopumā šie ilustratīvie momentuzņēmumi atbalsta tēzi, ka epiģenētiskā pārprogrammēšana bez mutācijas tiks pieņemta kā patiesa iespējošana iezīme, kas palīdz atvieglot raksturīgo spēju iegūšanu (3. att.), kas atšķiras no genoma DNS nestabilitātes un mutācijas. Jo īpaši var sagaidīt, ka nemutācijas epiģenētiskā pārprogrammēšana būs neatņemama sastāvdaļa, lai nodrošinātu iepriekš apspriesto fenotipiskā plastiskuma sākotnējo īpašību, jo īpaši kā dinamiskās transkriptomiskās neviendabības dzinējspēku, kas arvien labāk tiek dokumentēta ļaundabīgo vēža šūnu TME. Vienšūnu multi-omic profilēšanas tehnoloģiju attīstība izgaismos attiecīgo ieguldījumu un mijiedarbību starp mutāciju virzītu un mutāciju nevadītu epiģenētisko regulējumu audzēju attīstībā ļaundabīgas progresēšanas un metastāžu laikā.
Polimorfie mikrobiomi
Tālejoša biomedicīnas robeža atklājas, izgaismojot mikroorganismu daudzveidību un mainīgumu, kopā sauktu par mikrobiotu, kas simbiotiski asociējas ar ārējās vides iedarbībai pakļautajiem ķermeņa barjeras audiem - īpaši ar kuņģa-zarnu trakta epidermu un iekšējo gļotādu, kā arī ar krūts un plaušu sistēmu.
Arvien vairāk tiek atzīts, ka rezidentu baktēriju un sēnīšu radītajām ekosistēmām — mikrobiomiem — ir liela ietekme uz veselību un slimībām (87), un to veicina spēja pārbaudīt mikrobu sugu populācijas, izmantojot nākamās paaudzes sekvencēšanas un bioinformātikas tehnoloģijas. Attiecībā uz vēzi pierādījumi kļūst arvien pārliecinošāki, ka mikrobiomu polimorfā mainīgums starp indivīdiem populācijā var būtiski ietekmēt vēža fenotipus (88, 89).
Asociācijas pētījumi par cilvēku un eksperimentālām manipulācijām ar vēža peles modeļiem atklāj noteiktus mikroorganismus, galvenokārt, bet ne tikai baktērijas, kam var būt aizsargājoša vai kaitīga ietekme uz vēža attīstību, ļaundabīgu progresēšanu un reakciju uz terapiju. Tas attiecas arī uz audu mikrobioma globālo sarežģītību un sastāvu kopumā. Lai gan zarnu mikrobioms bija šīs jaunās robežas pionieris, vairākiem audiem un orgāniem ir saistīti mikrobiomi, kuriem ir raksturīgas iezīmes, kas saistītas ar populācijas dinamiku un mikrobu sugu un pasugu daudzveidību.
Šī pieaugošā izpratne par polimorfiski mainīgo mikrobiomu nozīmi veselībā un slimībās rada jautājumu: vai mikrobioms ir atšķirīga pazīme, kas plaši ietekmē gan pozitīvi, gan negatīvi vēža atšķirīgu spēju iegūšanu? Tālāk es apsveru šo iespēju un ilustrēju pierādījumus par dažiem ievērojamiem audu mikrobiomiem, kas saistīti ar vēža pazīmēm (4. att.), sākot ar visievērojamāko un šķietami ietekmīgāko zarnu trakta mikrobiomu.
4. attēls
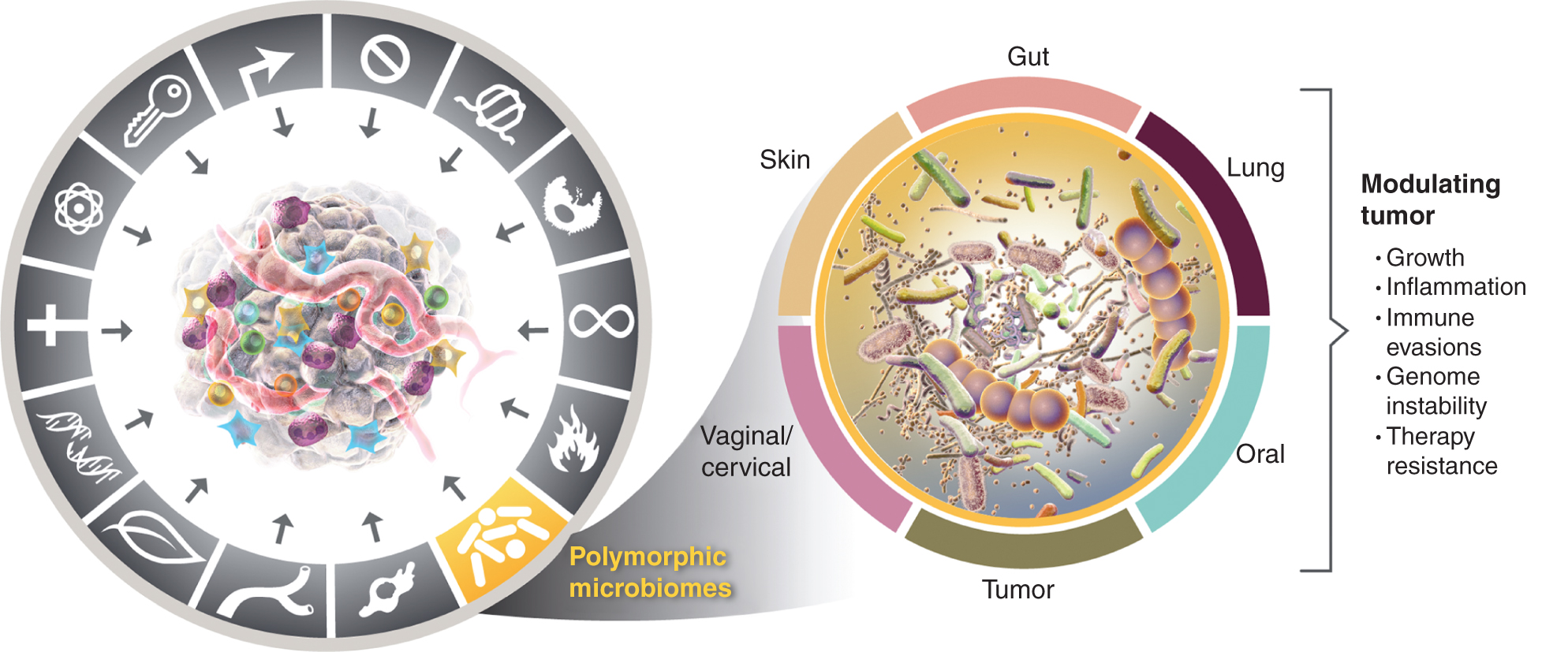
Pa kreisi, lai gan audzēju veicinošā iekaisuma un genoma nestabilitātes un mutāciju veicinošās īpašības pārklājas, arvien vairāk ir pamats secināt, ka polimorfie mikrobiomi, kas atrodas vienā indivīdā salīdzinājumā ar citu resnajā zarnā, citās gļotādās un saistītajos orgānos vai pašos audzējos, var ietekmēt daudzas raksturīgās spējas dažādos veidos - vai nu ar indukciju vai inhibīciju, un tādējādi var būt kā mīklu instruments. vēzis attīstās, progresē un aug, reaģē uz terapiju. Tiesa, audzēja fenotipu modulēšanā ir iesaistīti vairāki audu mikrobiomi. Papildus plaši pētītajam zarnu mikrobiomam, citi raksturīgi audu mikrobiomi, kā arī audzēja mikrobioms ir iesaistīti noteiktos audzēju tipos raksturīgo spēju iegūšanas modulēšanā - gan pozitīvā, gan negatīvā. Vēža grafikas preču zīmes tika pārņemtas no Hanahan un Weinberg (2).
Vairāki zarnu mikrobioma modulējošie efekti
Jau sen ir zināms, ka zarnu mikrobioms ir būtisks resnās zarnas (resnās zarnas) funkcijai, sadalot un ievedot organismā barības vielas kā daļu no vielmaiņas homeostāzes, un ka mikrobu populāciju pārrāvums – disbioze – resnajā zarnā var izraisīt virkni fizioloģisko slimību (87). Tas ietver aizdomas, ka resnās zarnas vēža uzņēmību, attīstību un patoģenēzi ietekmē zarnu mikrobioms. Pēdējos gados pārliecinošos funkcionālos pētījumos, izmantojot fekāliju transplantātus no pacientiem ar resnās zarnas audzēju un pelēm uz recipientu pelēm, kurām ir nosliece uz resnās zarnas vēža attīstību, ir noteikts princips: ir gan vēzi aizsargājoši, gan audzēju veicinoši mikrobiomi, kuros iesaistītas specifiskas baktēriju sugas, kas var modulēt resnās zarnas audzēju rašanos un patoģenēzi (90).
Mehānismi, ar kuriem mikrobiota piešķir šīs modulējošās lomas, joprojām tiek noskaidroti, taču arvien vairāk tiek noskaidroti divi vispārīgi efekti attiecībā uz audzēju veicinošiem mikrobiomiem un dažos gadījumos uz specifiskām audzēju veicinošām baktēriju sugām. Pirmais efekts ir resnās zarnas epitēlija mutaģenēze baktēriju toksīnu un citu molekulu ražošanas rezultātā, kas vai nu tieši bojā DNS, vai arī izjauc sistēmas, kas uztur genoma integritāti vai citādi stresa šūnas, netieši ietekmējot DNS replikācijas un labošanas precizitāti. Tipisks piemērs ir E. coli, kurā ir PKS lokuss, kas, kā pierādīts, mutagenizē cilvēka genomu un ir iesaistīts mutāciju pārnešanā, kas nodrošina zīmi (91).
Turklāt ir ziņots, ka baktērijas saistās ar resnās zarnas epitēlija šūnu virsmu un ražo ligandu mimētikas līdzekļus, kas stimulē epitēlija proliferāciju, veicinot raksturīgo proliferatīvo signālu spēju neoplastiskajās šūnās (88). Vēl viens mehānisms, ar kuru specifiski baktēriju veidi veicina audzēja attīstību, ir butirātu ražojošās baktērijas, kuru daudzums ir palielināts pacientiem ar kolorektālo vēzi (92).
Metabolīta butirāta ražošanai ir sarežģīta fizioloģiska iedarbība, tostarp novecojošu epitēlija un fibroblastu šūnu indukcija. Peles resnās zarnas kanceroģenēzes modelim, kas kolonizēts ar butirātu ražojošām baktērijām, attīstījās vairāk audzēju nekā pelēm, kurām šādu baktēriju nebija; Saikne starp butirāta izraisītu novecošanos un palielinātu resnās zarnas audzēju ģenēzi ir pierādīta, izmantojot senolītiskas zāles, kas nogalina novecojošās šūnas, kavējot audzēja augšanu (92).
Turklāt baktēriju radītajam butirātam ir pleiotropiska un paradoksāla iedarbība uz diferencētām šūnām, salīdzinot ar nediferencētām (cilmes) šūnām resnās zarnas epitēlija apstākļos, kad zarnu barjera ir traucēta (disbioze) un baktērijas ir invazīvas, ietekmējot, piemēram, šūnu enerģiju un vielmaiņu, histonu modifikāciju, šūnu cikla progresēšanu, kas nomāc imūnsistēmu un nomāc imūnsistēmu. imūnās atbildes reakcijas (93).
Patiešām, plaša polimorfo mikrobiomu darbība ietver adaptīvo un iedzimto imūnsistēmu modulāciju, izmantojot dažādus ceļus, tostarp baktēriju “imūnmodulējošus” faktorus, kas aktivizē bojājumu sensorus epitēlija vai pastāvīgās imūnās šūnās, izraisot daudzveidīga ķīmokīnu un citokīnu repertuāra izpausmi, kā arī veidojot imunokoliju šūnu populācijas un šūnu bagātības. pamatā esošā stroma un drenējošie limfmezgli.
Turklāt dažas baktērijas var pārkāpt gan aizsargājošo bioplēvi, gan gļotas, kas klāj resnās zarnas epitēliju, un izjaukt epitēlija šūnu un šūnu ciešos savienojumus, kas kopīgi uztur fiziskās barjeras integritāti, kas parasti sadala zarnu mikrobiomu. Iekļūstot stromā, baktērijas var izraisīt gan iedzimtas, gan adaptīvas imūnās atbildes, izraisot citokīnu un kemokīnu repertuāra sekrēciju. Viena no izpausmēm var būt audzēju veicinošas vai audzēju antagonistiskas imūnās mikrovides izveidošana, kas attiecīgi aizsargā pret audzēju ģenēzi un ļaundabīgu progresēšanu vai veicina to.
Attiecīgi (i) (iedzimta) audzēju veicinoša iekaisuma izraisīšanas un (ii) izbēgšanas no (adaptīvās) imūnās iznīcināšanas, ko izraisa raksturīgi mikrobiomi atsevišķiem pacientiem, savstarpēji saistīto parametru modulācija var būt saistīta ne tikai ar prognozi, bet arī ar reakciju vai rezistenci pret imūnterapijām ar imūnkontroles punktu inhibitoriem un citām audzēja terapeitiskajām metodēm, kas var veicināt imunitātes izpausmes veidošanu (viena no audzēja izpausmēm). mikrovides, kas attiecīgi rodas Aizsargā vai veicina audzēju attīstību un ļaundabīgo audzēju progresēšanu.
Attiecīgi (i) (iedzimta) audzēju veicinoša iekaisuma izraisīšanas un (ii) izbēgšanas no (adaptīvās) imūnās iznīcināšanas, ko izraisa raksturīgi mikrobiomi atsevišķiem pacientiem, savstarpēji saistīto parametru modulācija var būt saistīta ne tikai ar prognozi, bet arī ar reakciju vai rezistenci pret imūnterapijām ar imūnkontroles punktu inhibitoriem un citām audzēja terapeitiskajām metodēm, kas var veicināt imunitātes izpausmes veidošanu (viena no audzēja izpausmēm). mikrovides, kas attiecīgi rodas, aizsargā vai veicina audzēju attīstību un ļaundabīgo audzēju progresēšanu).
Attiecīgi i) (iedzimta) audzēju veicinoša iekaisuma ierosināšanas un (ii) izbēgšanas no (adaptīvās) imūnās iznīcināšanas ar atšķirīgu mikrobiomu savstarpējo parametru modulēšana atsevišķiem pacientiem var būt saistīta ne tikai ar prognozi, bet arī ar reakciju vai rezistenci pret imūnterapijām ar imūnās kontrolpunkta inhibitoriem un citām terapeitiskām metodēm (89, 94). Sākotnējais koncepcijas pierādījums nāk no neseniem pētījumiem, kas parāda atjaunotu imūnterapijas efektivitāti pēc fekāliju mikrobiotas transplantācijas no terapijas reaģētājiem pacientiem ar melanomu, kas bija progresējusi iepriekšējās ārstēšanas laikā ar imūnās kontrolpunkta blokādi (97, 98).
Molekulārie mehānismi, ar kuriem atšķirīgi un mainīgi zarnu mikrobioma komponenti sistēmiski modulē adaptīvās imūnsistēmas aktivitāti, joprojām ir pastāvīgs noslēpums, vai nu pastiprinot pretvēža imūnās atbildes, ko izraisa imūnās kontrolpunkta blokāde, vai, drīzāk, izraisot sistēmisku vai lokālu (intratumorālu) imūnsupresiju. Nesenais pētījums ir atklājis: daži Enterococcus (un citu baktēriju) celmi ekspresē peptidoglikāna hidroliāzi, ko sauc par SagA, kas atbrīvo no baktēriju sienas mukopeptīdus, kas pēc tam var sistēmiski cirkulēt un aktivizēt NOD2 modeļa receptoru, kas savukārt palielina T-šūnu atbildes reakciju un kontrolpunktu imūnterapijas efektivitāti (99).
Tiek identificētas un funkcionāli novērtētas citas imūnregulācijas molekulas, ko ražo specifiskas baktēriju pasugas, tostarp baktēriju ražotais inozīns, T šūnu aktivitātes ātrumu ierobežojošs metabolīts (100). Šie un citi piemēri sāk definēt molekulāros mehānismus, ar kuriem polimorfie mikrobiomi netieši un sistēmiski modulē audzēja imunobioloģiju, pārsniedzot imūnās atbildes reakcijas, kas seko baktēriju tiešai fiziskai mijiedarbībai ar imūnsistēmu (101, 102).
Papildus cēloņsakarībām ar resnās zarnas vēzi un melanomu, pierādītā zarnu mikrobioma spēja izraisīt imūnmodulējošu ķīmokīnu un citokīnu ekspresiju, kas nonāk sistēmiskajā cirkulācijā, arī acīmredzami spēj ietekmēt vēža patoģenēzi un reakciju uz terapiju citos ķermeņa orgānos (94, 95).
Spilgts piemērs attiecas uz holangiokarcinomu attīstību aknās: zarnu disbioze ļauj baktērijām un baktēriju produktiem iekļūt un transportēt caur vārtu vēnu uz aknām, kur hepatocītos ekspresētais TLR4 tiek aktivizēts, lai izraisītu ķīmokīna CXCL1 ekspresiju, kas vervē CXCR2 ekspresējošās šūnas, kas kalpo dabiskām granulocītu šūnām (supresēt SC). izvairīties no imūnsistēmas iznīcināšanas (103) un, iespējams, nodot citas atšķirīgas spējas (85). Tādējādi zarnu mikrobioms ir nepārprotami iesaistīts kā veicinošs līdzeklis, kas var alternatīvi atvieglot vai aizsargāt pret vairākiem vēža veidiem.
Ārpus zarnām: atšķirīgu mikrobiomu iesaistīšana citos barjeras audos
Gandrīz visi audi un orgāni, kas ir tieši vai netieši pakļauti ārējai videi, ir arī komensālo mikroorganismu krātuves (104). Atšķirībā no zarnām, kur mikrobioma simbiotiskā loma vielmaiņā ir labi atpazīstama, šajās dažādajās vietās joprojām parādās pastāvīgās mikrobiotas normālās un patogēnās lomas.
Pastāv acīmredzamas orgānu / audu specifiskas atšķirības saistīto mikrobiomu konstitūcijā homeostāzes, novecošanas un vēža gadījumā, gan pārklājoties, gan ar atšķirīgām sugām un frekvencēm ar resnās zarnas sugām un biežumiem (104, 105). Turklāt asociācijas pētījumi sniedz arvien vairāk pierādījumu tam, ka lokāli audzēju antagonizējoši/aizsargājoši pret audzēju veicinošiem audu mikrobiomiem, līdzīgi kā zarnu mikrobiomā, var modulēt uzņēmību un patoģenēzi pret cilvēka vēzi, kas rodas ar tiem saistītajos orgānos (106-109).
Intratumorālās mikrobiotas ietekme?
Visbeidzot, patologi jau sen ir atzinuši, ka baktērijas var atklāt cietos audzējos, un šis novērojums tagad ir pamatots ar sarežģītām profilēšanas tehnoloģijām. Piemēram, pētījumā ar 1526 audzējiem, kas aptver septiņus cilvēka vēža veidus (kaulu, smadzeņu, krūts, plaušu, melanomas, olnīcu un aizkuņģa dziedzera), katram veidam bija raksturīgs īpašs mikrobioms, kas galvenokārt atrodas vēža šūnās un imūnās šūnās. Katram audzēja veidam ir pierādītas audzēja mikrobioma variācijas un secināts, ka tās ir saistītas ar klīniski patoloģiskām iezīmēm (110).
Mikrobiota ir līdzīgi atklāta de novo ģenētiski modificētos plaušu un aizkuņģa dziedzera vēža peļu modeļos, un var pierādīt, ka to neesamība pelēm bez baktērijām un/vai to atcelšana ar antibiotikām pasliktina audzēja ģenēzi, funkcionāli iesaistot audzēja mikrobiomu kā audzēju veicinoša iekaisuma un ļaundabīga progresēšanas priekšteci (11211).
Asociācijas pētījumi par cilvēka aizkuņģa dziedzera kanāla adenokarcinomu un funkcionālie testi, izmantojot fekāliju transplantāciju pelēm, kurām ir audzējs, ir parādījuši, ka audzēja mikrobioma un ar to saistītā zarnu mikrobioma variācijas modulē imūnsistēmas fenotipus un izdzīvošanu (113). Nākotnes svarīgs izaicinājums būs paplašināt šīs ietekmes uz citiem audzēju veidiem un atdalīt potenciāli atdalāmo audzēja mikrobioma uzbūves un variācijas ieguldījumu no zarnu mikrobioma (un vietējā izcelsmes audu) ieguldījumiem, iespējams, identificējot konkrētas mikrobu sugas, kas ir funkcionāli ietekmīgas vienā vai otrā vietā.
Kopsavilkums
Interesanti nākotnes jautājumi ir par to, vai mikrobiotai, kas dzīvo dažādos audos vai apdzīvo sākotnēju neoplazmu, ir iespēja veicināt vai traucēt citu atšķirīgu spēju iegūšanu, izņemot imūnmodulāciju un genoma mutāciju, tādējādi ietekmējot audzēja attīstību un progresēšanu. Ir pierādījumi, ka noteiktas baktēriju sugas var tieši stimulēt proliferatīvās signalizācijas pazīmi, piemēram, resnās zarnas epitēlijā (88) un var modulēt augšanas nomākšanu, mainot audzēja nomācēju aktivitāti dažādos zarnu nodalījumos (114), savukārt tiešā veidā ietekmē citas raksturīgās spējas, piemēram, izvairoties no šūnu nāves, izraisot vispārēju metastāžu, saglabājas angioģenēzes stimulēšana un stimulēšana. no šiem novērojumiem vairākām cilvēka vēža formām.
Neskatoties uz to, arvien vairāk izskan pārliecinoši argumenti, ka zarnu un citu orgānu mikrobiomu polimorfās variācijas ir raksturīga aktivizējoša iezīme atšķirīgu prasmju iegūšanai (4. att.), pat ja tā pārklājas un papildina genoma nestabilitātes un mutāciju, kā arī audzēju veicinoša iekaisuma pazīmes.
Novecojošās šūnas
Šūnu novecošanās ir parasti neatgriezenisks proliferācijas apstāšanās veids, kas, iespējams, attīstījās kā aizsargmehānisms audu homeostāzes uzturēšanai, šķietami kā papildu mehānisms ieprogrammētai šūnu nāvei, kas kalpo slimu, disfunkcionālu vai citādi nevajadzīgu šūnu inaktivēšanai un ar laiku izvadīšanai. Papildus šūnu dalīšanās cikla slēgšanai novecošanas programma rada izmaiņas šūnu morfoloģijā un vielmaiņā un, visdziļāk, ar novecošanos saistītā sekrēcijas fenotipa (SASP) aktivizēšanu, kas ietver daudzu bioaktīvu proteīnu, tostarp chemokīnu, izdalīšanos.
Citokīni un proteāzes, kuru identitāte ir atkarīga no šūnas un audu veida, no kura rodas novecojoša šūna (115–117). Novecošanos šūnās var izraisīt dažādi apstākļi, tostarp mikrovides spriedzes, piemēram, barības vielu bads un DNS bojājumi, kā arī orgānu un šūnu infrastruktūras bojājumi un nelīdzsvarotība šūnu signalizācijas tīklos (115, 117), un tas viss ir noticis saistībā ar novēroto novecojošo šūnu biežuma palielināšanos (1, 1918 dažādos orgānos).
Šūnu novecošanās jau sen tiek uzskatīta par aizsardzības mehānismu pret neoplāziju, izraisot vēža šūnu novecošanos (120). Lielākā daļa no iepriekšminētajiem novecošanas programmas iniciatoriem ir saistīti ar ļaundabīgiem audzējiem, īpaši ar DNS bojājumiem novirzes hiperproliferācijas rezultātā, tā saukto onkogēnu izraisītu novecošanos hiperaktivētas signalizācijas dēļ un terapijas izraisītu novecošanos šūnu un genoma bojājumu rezultātā, ko izraisa ķīmijterapija un staru terapija.
Patiešām, ir vispāratzīti piemēri novecošanās aizsargājošajiem ieguvumiem, ierobežojot ļaundabīgo audzēju progresēšanu (118, 119). Tomēr, gluži pretēji, arvien vairāk pierādījumu liecina par pretējo: noteiktos kontekstos novecojošas šūnas atšķirīgi stimulē audzēja attīstību un ļaundabīgo audzēju progresēšanu (119, 121).
Pārdomātā gadījuma izpētē novecojošās peles tika farmakoloģiski noņemtas, īpaši noplicinot novecojošās šūnas, kas raksturīgi ekspresē šūnu cikla inhibitoru p16 – INK4a: papildus vairāku ar vecumu saistītu simptomu aizkavēšanai tas izraisīja novecojošo šūnu samazināšanos novecojošām pelēm ar samazinātu spontānas audzēja ģenēzes un vēža izraisītas nāves gadījumu skaitu (1).
Tiek uzskatīts, ka galvenais mehānisms, ar kuru novecojošās šūnas veicina audzēja fenotipus, ir SASP, kas, kā pierādīts, spēj būt parakrīnā veidā starpnieks signālmolekulās (un proteāzes, kas aktivizē un/vai dezaktivē), lai mediētu tipiskās spējas. Tādējādi dažādās eksperimentālās sistēmās ir pierādīts, ka novecojošas vēža šūnas dažādos veidos veicina proliferatīvu signālu pārraidi, izvairās no apoptozes, inducē angiogenēzi, stimulē invāziju un metastāzes un nomāc audzēja imunitāti (116, 118, 120, 121).
Vēl viens novecojošu vēža šūnu ietekmes aspekts uz vēža fenotipiem ietver pārejošus, atgriezeniskus novecojošu šūnu stāvokļus, kā rezultātā novecojošās vēža šūnas var izvairīties no sava SASP ekspresējošā, neproliferatīvā stāvokļa un atsākt šūnu proliferāciju un pilnībā dzīvotspējīgu onkogēnu šūnu saistīto spēju izpausmi (44).
Šāda pārejoša novecošanās ir vislabāk dokumentēta terapijas rezistences gadījumos (44), kas ir klusuma forma, kas izvairās no proliferējošo vēža šūnu terapeitiskās mērķēšanas, bet var izrādīties efektīvāka citos audzēja attīstības, ļaundabīgas progresēšanas un metastāžu posmos.
Turklāt novecojošu šūnu īpašības veicinošās spējas neaprobežojas tikai ar novecojošām vēža šūnām. Ir pierādīts, ka ar vēzi saistītie fibroblasti (CAF) noveco audzējos, radot novecojošus CAF, kas, kā pierādīts, ir audzēju veicinoši, piešķirot vēža šūnām raksturīgas spējas TME (115, 116, 121).
Turklāt novecojoši fibroblasti normālos audos, ko daļēji veido dabiska novecošanās vai vides apvainojumi, līdzīgi ir iesaistīti audu mikrovides pārveidošanā, izmantojot SASP, lai nodrošinātu parakrīno atbalstu vietējai invāzijai (tā sauktajiem “lauka efektiem”) un attālām metastāzēm (116) audzējiem, kas attīstās tuvumā.
Turklāt ir pierādīts, ka novecojoši fibroblasti novecojošā ādā, izmantojot SASP, piesaista iedzimtas imūnās šūnas, kas gan imūnsupresē adaptīvas pretvēža imūnās atbildes reakcijas, ko nostiprina CD8 T šūnas, gan stimulē ādas audzēju augšanu (123), un pēdējais efekts, iespējams, atspoguļo šādu iedzimtu imūno šūnu, nekrophabiliju šūnu un citu nekrophabiliju šūnu (mielofīlo šūnu) parakrīno ieguldījumu. atspoguļo.
Lai gan ir mazāk labi zināms, šķiet, ka citas bagātīgas stromas šūnas, kas apdzīvo specifisku audzēju mikrovidi, novecos, tādējādi modulējot vēža īpašības un no tā izrietošos audzēja fenotipus. Piemēram, terapijas izraisītas novecojošas audzēja endotēlija šūnas var uzlabot proliferāciju, invāziju un metastāzes krūts vēža modeļos (124, 125).
Protams, šādi pierādījumi prasa izmeklēšanu citos audzēju veidos, lai novērtētu fibroblastu, endotēlija šūnu un citu stromas šūnu vispārēju novecošanos kā audzēja attīstības virzītājspēku. Pašlaik nav arī skaidrības par regulējošiem mehānismiem un funkcionāliem noteicošajiem faktoriem, ar kuriem konkrēts novecojošs šūnu tips konkrētā TME izraisa audzēju veicinošu, salīdzinot ar audzēju antagonistu SASP, ko acīmredzot var izraisīt alternatīvi tajā pašā novecojošo šūnu tipā, iespējams, ar dažādiem iniciatoriem, kad tas ir iegremdēts raksturīgā fizioloģiskā un neoplastiskā mikrovidē.
Kopsavilkums
Koncepcija, ka audzēji sastāv no ģenētiski pārveidotām vēža šūnām, kas mijiedarbojas ar vervētām un epiģenētiski/fenotipiski bojātām palīgšūnām (stromas) un gūst labumu no tām, ir noteikta kā izšķiroša vēža patoģenēzē. Iepriekš apspriestie un šeit (un citur) citētajos pārskatos un ziņojumos aprakstītie apsvērumi pārliecinoši apgalvo, ka novecojošas šūnas (neatkarīgi no šūnu izcelsmes) ir jāapsver, lai tās iekļautu audzēja mikrovides funkcionāli nozīmīgu šūnu sarakstā (5. att.). Tāpēc, meklējot padziļinātas zināšanas par vēža mehānismiem, jāņem vērā novecojošās šūnas. Turklāt to nozīmes atzīšana motivē sekundāro mērķi terapeitiski mērķēt uz visu konstitūciju audzēju veicinošām novecojošām šūnām, neatkarīgi no tā, vai tas notiek ar farmakoloģisku vai imunoloģisku ablāciju vai pārprogrammējot SASP audzēju antagonizējošos variantos (115, 121, 126).
5. attēls

Heterogēni vēža šūnu apakštipi un stromas šūnu tipi un apakštipi ir funkcionāli integrēti audzēju kā nelegālu orgānu izpausmēs. Arvien vairāk pierādījumu liecina, ka daudzu šo TME šūnu komponentu un to mainīgo SASP novecojošie šūnu atvasinājumi ir iesaistīti raksturīgo spēju un no tā izrietošo audzēja fenotipu modulācijā. Vēža grafikas preču zīmes tika pārņemtas no Hanahan un Weinberg (2).
Noslēguma piezīmes
Lai gan ir pierādījies, ka astoņām vēža pazīmēm un to divām atbalsta iezīmēm ir noturīga heiristiskā vērtība vēža konceptualizācijā, iepriekš minētie apsvērumi liecina, ka var rasties jauni vispārīguma aspekti un tāpēc tie ir svarīgi, lai pilnīgāk izprastu slimības sarežģītību, mehānismus un izpausmes. Lietojot saskatāmas, ja ne pilnīgas, neatkarības metriku no 10 galvenajiem atribūtiem, var apgalvot, ka šie četri parametri pēc turpmākas apstiprināšanas un vispārināšanas, kas pārsniedz sniegtos gadījumu izpēti, var tikt integrēti vēža shēmas pazīmēs (6. attēls).
Tāpēc ievērojamo spēju sarakstam varētu pievienot šūnu plastiskumu. Lai gan astotais kodols un šī nouveau spēja ir konceptuāli atšķirami pēc to definīcijas kā raksturīgas pazīmes, to regulēšanas aspekti ir vismaz daļēji saistīti dažos un, iespējams, daudzos vēža veidos. Piemēram, vairākas raksturīgās pazīmes ir saskaņoti modulētas ar kanoniskiem onkogēniem faktoriem dažos audzēju veidos, tostarp
- (I) KRAS ( https://cancer.sanger.ac.uk/cosmic/census-page/KRAS ),
- (II) MYC ( https://cancer.sanger.ac.uk/cosmic/census-page/MYC ),
- (III) NOTCH ( https://cancer.sanger.ac.uk/cosmic/census-page/NOTCH1 ; Ref. 127) und
- (IV) TP53 ( https://cancer.sanger.ac.uk/cosmic/census-page/TP53 )
6. attēls
Tiek parādīti kanoniskie un gaidāmie jaunie papildinājumi “Vēža pazīmēm”. Šajā dokumentā ir izvirzīta iespēja, lai veicinātu debates, diskusijas un eksperimentālu izstrādi, ka daži vai visi no četriem jaunajiem parametriem tiks atzīti par vispārīgiem vairākām cilvēka vēža formām un tāpēc piemēroti integrācijai vēža pazīmju pamatkonceptualizācijā. Vēža grafikas preču zīmes tika pārņemtas no Hanahan un Weinberg (2).
Papildus šūnu plastiskuma pievienošanai sarakstam nemutācijas epiģenētisko pārprogrammēšanu un polimorfās variācijas var integrēt orgānu/audu mikrobiomos kā mehāniskus noteicošos faktorus — veicinošas īpašības —, ar kuru palīdzību tiek iegūtas atšķirīgas spējas, kā arī audzēju veicinošs iekaisums (kas pats par sevi ir daļēji saistīts ar mikrobiomu un citiem, kas izpaužas kā iepriekš minētās mutācijas).
Visbeidzot, dažādas izcelsmes novecojošas šūnas, tostarp vēža šūnas un dažādas stromas šūnas, kas funkcionāli veicina vēža attīstību un ļaundabīgu progresēšanu, kaut arī ievērojami atšķirīgos veidos no to ne-vecojošo brāļu šūnām, var iekļaut kā TME vispārīgus komponentus. Kopumā ir paredzēts, ka šo sākotnējo "eksperimentālo balonu" izvietošana veicinās debates, diskusijas un turpmāku eksperimentālu izmeklēšanu vēža pētnieku aprindās par vēža bioloģijas, ģenētikas un patoģenēzes konceptuālo parametru noteikšanu.
Atsauces
- Hanahan D , Weinberg RA . The hallmarks of cancer. Cell 2000;100:57–70.
- Hanahan D , Weinberg RA . Hallmarks of cancer: the next generation. Cell 2011;144:646–74.
- Yuan S , Norgard RJ , Stanger BZ . Cellular plasticity in cancer. Cancer Discov 2019;9:837–51.
- Barker N , Ridgway RA , van Es JH , van de Wetering M , Begthel H , van den Born M et al . Crypt stem cells as the cells-of-origin of intestinal cancer. Nature 2009;457:608–11.
- Perekatt AO , Shah PP , Cheung S , Jariwala N , Wu A , Gandhi V et al . SMAD4 suppresses WNT-driven dedifferentiation and oncogenesis in the differentiated gut epithelium. Cancer Res 2018;78:4878–90.
- Shih IM , Wang TL , Traverso G , Romans K , Hamilton SR , Ben-Sasson S et al . Top-down morphogenesis of colorectal tumors. Proc Natl Acad Sci U S A 2001;98:2640–5.
- Ordóñez-Morán P , Dafflon C , Imajo M , Nishida E , Huelsken J . HOXA5 counteracts stem cell traits by inhibiting Wnt signaling in colorectal cancer. Cancer Cell 2015;28:815–29.
- Tan SH , Barker N . Stemming colorectal cancer growth and metastasis: HOXA5 forces cancer stem cells to differentiate. Cancer Cell 2015;28:683–5.
- Köhler C , Nittner D , Rambow F , Radaelli E , Stanchi F , Vandamme N et al . Mouse cutaneous melanoma induced by mutant BRaf arises from expansion and dedifferentiation of mature pigmented melanocytes. Cell Stem Cell 2017;21:679–93.
- Shah M , Bhoumik A , Goel V , Dewing A , Breitwieser W , Kluger H et al . A role for ATF2 in regulating MITF and melanoma development. PLoS Genet 2010;6:e1001258.
- Claps G , Cheli Y , Zhang T , Scortegagna M , Lau E , Kim H et al . A transcriptionally inactive ATF2 variant drives melanomagenesis. Cell Rep 2016;15:1884–92.
- Saghafinia S , Homicsko K , Di Domenico A , Wullschleger S , Perren A , Marinoni I et al . Cancer cells retrace a stepwise differentiation program during malignant progression. Cancer Discov 2021;11:2638–57.
- Yu X-X , Qiu W-L , Yang L , Zhang Y , He M-Y , Li L-C et al . Defining multistep cell fate decision pathways during pancreatic development at single-cell resolution. EMBO J 2019;38:e100164.
- de Thé H . Differentiation therapy revisited. Nat Rev Cancer 2018;18:117–27.
- He LZ , Merghoub T , Pandolfi PP . In vivo analysis of the molecular pathogenesis of acute promyelocytic leukemia in the mouse and its therapeutic implications. Oncogene 1999;18:5278–92.
- Warrell RP , de Thé H , Wang ZY , Degos L . Acute promyelocytic leukemia. N Engl J Med 1993;329:177–89.
- Bots M , Verbrugge I , Martin BP , Salmon JM , Ghisi M , Baker A et al . Differentiation therapy for the treatment of t(8;21) acute myeloid leukemia using histone deacetylase inhibitors. Blood 2014;123:1341–52.
- Ferrara FF , Fazi F , Bianchini A , Padula F , Gelmetti V , Minucci S et al . Histone deacetylase-targeted treatment restores retinoic acid signaling and differentiation in acute myeloid leukemia. Cancer Res 2001;61:2–7.
- Kaufman CK , Mosimann C , Fan ZP , Yang S , Thomas AJ , Ablain J et al . A zebrafish melanoma model reveals emergence of neural crest identity during melanoma initiation. Science 2016;351:aad2197.
- Morris JP , Yashinskie JJ , Koche R , Chandwani R , Tian S , Chen C-C et al . α-Ketoglutarate links p53 to cell fate during tumour suppression. Nature 2019;573:595–9.
- Saha SK , Parachoniak CA , Ghanta KS , Fitamant J , Ross KN , Najem MS et al . Mutant IDH inhibits HNF-4α to block hepatocyte differentiation and promote biliary cancer. Nature 2014;513:110–4.
- Dang L , Su S-SM . Isocitrate dehydrogenase mutation and (R)-2-hydroxyglutarate: from basic discovery to therapeutics development. Annu Rev Biochem 2017;86:305–31.
- Waitkus MS , Diplas BH , Yan H . Biological role and therapeutic potential of IDH mutations in cancer. Cancer Cell 2018;34:186–95.
- Phan TG , Croucher PI . The dormant cancer cell life cycle. Nat Rev Cancer 2020;20:398–411.
- Jiang M , Azevedo-Pouly AC , Deering TG , Hoang CQ , DiRenzo D , Hess DA et al . MIST1 and PTF1 collaborate in feed-forward regulatory loops that maintain the pancreatic acinar phenotype in adult mice. Mol Cell Biol 2016;36:2945–55.
- Krah NM , Narayanan SM , Yugawa DE , Straley JA , Wright CVE , MacDonald RJ et al . Prevention and reversion of pancreatic tumorigenesis through a differentiation-based mechanism. Dev Cell 2019;50:744–54.
- Krah NM , De La O J-P , Swift GH , Hoang CQ , Willet SG , Chen Pan F et al . The acinar differentiation determinant PTF1A inhibits initiation of pancreatic ductal adenocarcinoma. eLife 2015;4:e07125.
- Shi G , DiRenzo D , Qu C , Barney D , Miley D , Konieczny SF . Maintenance of acinar cell organization is critical to preventing Kras-induced acinar-ductal metaplasia. Oncogene 2013;32:1950–8.
- Kopp JL , von Figura G , Mayes E , Liu F-F , Dubois CL , Morris JP et al . Identification of Sox9-dependent acinar-to-ductal reprogramming as the principal mechanism for initiation of pancreatic ductal adenocarcinoma. Cancer Cell 2012;22:737–50.
- Julian LM , McDonald AC , Stanford WL . Direct reprogramming with SOX factors: masters of cell fate. Curr Opin Genet Dev 2017;46:24–36.
- Grimm D , Bauer J , Wise P , Krüger M , Simonsen U , Wehland M et al . The role of SOX family members in solid tumours and metastasis. Semin Cancer Biol 2020;67:122–53.
- Mu P , Zhang Z , Benelli M , Karthaus WR , Hoover E , Chen C-C et al . SOX2 promotes lineage plasticity and antiandrogen resistance in TP53- and RB1-deficient prostate cancer. Science 2017;355:84–8.
- Von Hoff DD , LoRusso PM , Rudin CM , Reddy JC , Yauch RL , Tibes R et al . Inhibition of the hedgehog pathway in advanced basal-cell carcinoma. N Engl J Med 2009;361:1164–72.
- Biehs B , Dijkgraaf GJP , Piskol R , Alicke B , Boumahdi S , Peale F et al . A cell identity switch allows residual BCC to survive Hedgehog pathway inhibition. Nature 2018;562:429–33.
- Boumahdi S , de Sauvage FJ . The great escape: tumour cell plasticity in resistance to targeted therapy. Nat Rev Drug Discov 2020;19:39–56.
- Groves SM , Ireland A , Liu Q , Simmons AJ , Lau K , Iams WT et al . Cancer Hallmarks Define a Continuum of Plastic Cell States between Small Cell Lung Cancer Archetypes [Internet]. Systems Biology; 2021 Jan. Available from: http://biorxiv.org/lookup/doi/10.1101/2021.01.22.427865.
- LaFave LM , Kartha VK , Ma S , Meli K , Del Priore I , Lareau C et al . Epigenomic state transitions characterize tumor progression in mouse lung adenocarcinoma. Cancer Cell 2020;38:212–28.
- Marjanovic ND , Hofree M , Chan JE , Canner D , Wu K , Trakala M et al . Emergence of a high-plasticity cell state during lung cancer evolution. Cancer Cell 2020;38:229–46.
- Drapkin BJ , Minna JD . Studying lineage plasticity one cell at a time. Cancer Cell 2020;38:150–2.
- Inoue Y , Nikolic A , Farnsworth D , Liu A , Ladanyi M , Somwar R et al . Extracellular signal-regulated kinase mediates chromatin rewiring and lineage transformation in lung cancer [Internet]. Cancer Biology; 2020 Nov. Available from: http://biorxiv.org/lookup/doi/10.1101/2020.11.12.368522.
- Dravis C , Chung C-Y , Lytle NK , Herrera-Valdez J , Luna G , Trejo CL et al . Epigenetic and transcriptomic profiling of mammary gland development and tumor models disclose regulators of cell state plasticity. Cancer Cell 2018;34:466–82.
- Malta TM , Sokolov A , Gentles AJ , Burzykowski T , Poisson L , Weinstein JN et al . Machine learning identifies stemness features associated with oncogenic dedifferentiation. Cell 2018;173:338–54.
- Miao Z-F , Lewis MA , Cho CJ , Adkins-Threats M , Park D , Brown JW et al . A dedicated evolutionarily conserved molecular network licenses differentiated cells to return to the cell cycle. Dev Cell 2020;55:178–94.
- De Blander H , Morel A-P , Senaratne AP , Ouzounova M , Puisieux A . Cellular plasticity: a route to senescence exit and tumorigenesis. Cancers 2021;13:4561.
- Merrell AJ , Stanger BZ . Adult cell plasticity in vivo: de-differentiation and transdifferentiation are back in style. Nat Rev Mol Cell Biol 2016;17:413–25.
- Baylin SB , Jones PA . Epigenetic determinants of cancer. Cold Spring Harb Perspect Biol 2016;8:a019505.
- Flavahan WA , Gaskell E , Bernstein BE . Epigenetic plasticity and the hallmarks of cancer. Science 2017;357:eaal2380.
- Jones PA , Issa J-PJ , Baylin S . Targeting the cancer epigenome for therapy. Nat Rev Genet 2016;17:630–41.
- Huang S . Tumor progression: Chance and necessity in Darwinian and Lamarckian somatic (mutationless) evolution. Prog Biophys Mol Biol 2012;110:69–86.
- Darwiche N . Epigenetic mechanisms and the hallmarks of cancer: an intimate affair. Am J Cancer Res 2020;10:1954–78.
- Feng Y , Liu X , Pauklin S . 3D chromatin architecture and epigenetic regulation in cancer stem cells. Protein Cell 2021;12:440–54.
- Nam AS , Chaligne R , Landau DA . Integrating genetic and non-genetic determinants of cancer evolution by single-cell multi-omics. Nat Rev Genet 2021;22:3–18.
- Bitman-Lotan E , Orian A . Nuclear organization and regulation of the differentiated state. Cell Mol Life Sci CMLS 2021;78:3141–58.
- Goldberg AD , Allis CD , Bernstein E . Epigenetics: a landscape takes shape. Cell 2007;128:635–8.
- Zeng Y , Chen T . DNA methylation reprogramming during mammalian development. Genes 2019;10:257.
- Hegde AN , Smith SG . Recent developments in transcriptional and translational regulation underlying long-term synaptic plasticity and memory. Learn Mem 2019;26:307–17.
- Kim S , Kaang B-K . Epigenetic regulation and chromatin remodeling in learning and memory. Exp Mol Med 2017;49:e281.
- Thienpont B , Van Dyck L , Lambrechts D . Tumors smother their epigenome. Mol Cell Oncol 2016;3:e1240549.
- Gameiro PA , Struhl K . Nutrient deprivation elicits a transcriptional and translational inflammatory response coupled to decreased protein synthesis. Cell Rep 2018;24:1415–24.
- Lin GL , Monje M . Understanding the deadly silence of posterior fossa A ependymoma. Mol Cell 2020;78:999–1001.
- Michealraj KA , Kumar SA , Kim LJY , Cavalli FMG , Przelicki D , Wojcik JB et al . Metabolic regulation of the epigenome drives lethal infantile ependymoma. Cell 2020;181:1329–45.
- Bakir B , Chiarella AM , Pitarresi JR , Rustgi AK . EMT, MET, plasticity, and tumor metastasis. Trends Cell Biol 2020;30:764–76.
- Gupta PB , Pastushenko I , Skibinski A , Blanpain C , Kuperwasser C . Phenotypic plasticity: driver of cancer initiation, progression, and therapy resistance. Cell Stem Cell 2019;24:65–78.
- Lambert AW , Weinberg RA . Linking EMT programmes to normal and neoplastic epithelial stem cells. Nat Rev Cancer 2021;21:325–38.
- Lindner P , Paul S , Eckstein M , Hampel C , Muenzner JK , Erlenbach-Wuensch K et al . EMT transcription factor ZEB1 alters the epigenetic landscape of colorectal cancer cells. Cell Death Dis 2020;11:147.
- Javaid S , Zhang J , Anderssen E , Black JC , Wittner BS , Tajima K et al . Dynamic chromatin modification sustains epithelial-mesenchymal transition following inducible expression of Snail-1. Cell Rep 2013;5:1679–89.
- Serrano-Gomez SJ , Maziveyi M , Alahari SK . Regulation of epithelial-mesenchymal transition through epigenetic and post-translational modifications. Mol Cancer 2016;15:18.
- Skrypek N , Goossens S , De Smedt E , Vandamme N , Berx G . Epithelial-to-mesenchymal transition: epigenetic reprogramming driving cellular plasticity. Trends Genet TIG 2017;33:943–59.
- Li L , Hanahan D . Hijacking the neuronal NMDAR signaling circuit to promote tumor growth and invasion. Cell 2013;153:86–100.
- Li L , Zeng Q , Bhutkar A , Galván JA , Karamitopoulou E , Noordermeer D et al . GKAP acts as a genetic modulator of NMDAR signaling to govern invasive tumor growth. Cancer Cell 2018;33:736–51.
- Mohammadi H , Sahai E . Mechanisms and impact of altered tumour mechanics. Nat Cell Biol 2018;20:766–74.
- Odenthal J , Takes R , Friedl P . Plasticity of tumor cell invasion: governance by growth factors and cytokines. Carcinogenesis 2016;37:1117–28.
- Torres CM , Biran A , Burney MJ , Patel H , Henser-Brownhill T , Cohen A-HS et al . The linker histone H1.0 generates epigenetic and functional intratumor heterogeneity. Science 2016;353:aaf1644.
- Puram SV , Tirosh I , Parikh AS , Patel AP , Yizhak K , Gillespie S et al . Single-cell transcriptomic analysis of primary and metastatic tumor ecosystems in head and neck cancer. Cell 2017;171:1611–24.
- Kinker GS , Greenwald AC , Tal R , Orlova Z , Cuoco MS , McFarland JM et al . Pan-cancer single-cell RNA-seq identifies recurring programs of cellular heterogeneity. Nat Genet 2020;52:1208–18.
- Murtha M , Esteller M . Extraordinary cancer epigenomics: thinking outside the classical coding and promoter box. Trends Cancer 2016;2:572–84.
- Nebbioso A , Tambaro FP , Dell’Aversana C , Altucci L . Cancer epigenetics: moving forward. PLoS Genet 2018;14:e1007362.
- Tavernari D , Battistello E , Dheilly E , Petruzzella AS , Mina M , Sordet-Dessimoz J et al . Non-genetic evolution drives lung adenocarcinoma spatial heterogeneity and progression. Cancer Discov 2021;11:1490–507.
- Heyn H , Vidal E , Ferreira HJ , Vizoso M , Sayols S , Gomez A et al . Epigenomic analysis detects aberrant super-enhancer DNA methylation in human cancer. Genome Biol 2016;17:11.
- Saghafinia S , Mina M , Riggi N , Hanahan D , Ciriello G . Pan-cancer landscape of aberrant DNA methylation across human tumors. Cell Rep 2018;25:1066–80.
- Audia JE , Campbell RM . Histone modifications and cancer. Cold Spring Harb Perspect Biol 2016;8:a019521.
- Corces MR , Granja JM , Shams S , Louie BH , Seoane JA , Zhou W et al . The chromatin accessibility landscape of primary human cancers. Science 2018;362:eaav1898.
- Esteve-Puig R , Bueno-Costa A , Esteller M . Writers, readers and erasers of RNA modifications in cancer. Cancer Lett 2020;474:127–37.
- Janin M , Coll-SanMartin L , Esteller M . Disruption of the RNA modifications that target the ribosome translation machinery in human cancer. Mol Cancer 2020;19:70.
- Hanahan D , Coussens LM . Accessories to the crime: functions of cells recruited to the tumor microenvironment. Cancer Cell 2012;21:309–22.
- Lu Z , Zou J , Li S , Topper MJ , Tao Y , Zhang H et al . Epigenetic therapy inhibits metastases by disrupting premetastatic niches. Nature 2020;579:284–90.
- Thomas S , Izard J , Walsh E , Batich K , Chongsathidkiet P , Clarke G et al . The host microbiome regulates and maintains human health: a primer and perspective for non-microbiologists. Cancer Res 2017;77:1783–812.
- Dzutsev A , Badger JH , Perez-Chanona E , Roy S , Salcedo R , Smith CK et al . Microbes and cancer. Annu Rev Immunol 2017;35:199–228.
- Helmink BA , Khan MAW , Hermann A , Gopalakrishnan V , Wargo JA . The microbiome, cancer, and cancer therapy. Nat Med 2019;25:377–88.
- Sears CL , Garrett WS . Microbes, microbiota, and colon cancer. Cell Host Microbe 2014;15:317–28.
- Pleguezuelos-Manzano C , Puschhof J , Rosendahl Huber A , van Hoeck A , Wood HM , Nomburg J et al . Mutational signature in colorectal cancer caused by genotoxic pks+ E. coli. Nature 2020;580:269–73.
- Okumura S , Konishi Y , Narukawa M , Sugiura Y , Yoshimoto S , Arai Y et al . Gut bacteria identified in colorectal cancer patients promote tumourigenesis via butyrate secretion. Nat Commun 2021;12:5674.
- Salvi PS , Cowles RA . Butyrate and the intestinal epithelium: modulation of proliferation and inflammation in homeostasis and disease. Cells 2021;10:1775.
- Fessler J , Matson V , Gajewski TF . Exploring the emerging role of the microbiome in cancer immunotherapy. J Immunother Cancer 2019;7:108.
- Gopalakrishnan V , Helmink BA , Spencer CN , Reuben A , Wargo JA . The influence of the gut microbiome on cancer, immunity, and cancer immunotherapy. Cancer Cell 2018;33:570–80.
- Zitvogel L , Ma Y , Raoult D , Kroemer G , Gajewski TF . The microbiome in cancer immunotherapy: diagnostic tools and therapeutic strategies. Science 2018;359:1366–70.
- Baruch EN , Youngster I , Ben-Betzalel G , Ortenberg R , Lahat A , Katz L et al . Fecal microbiota transplant promotes response in immunotherapy-refractory melanoma patients. Science 2021;371:602–9.
- Davar D , Dzutsev AK , McCulloch JA , Rodrigues RR , Chauvin J-M , Morrison RM et al . Fecal microbiota transplant overcomes resistance to anti–PD-1 therapy in melanoma patients. Science 2021;371:595–602.
- Griffin ME , Espinosa J , Becker JL , Luo J-D , Carroll TS , Jha JK et al . Enterococcus peptidoglycan remodeling promotes checkpoint inhibitor cancer immunotherapy. Science 2021;373:1040–6.
- Mager LF , Burkhard R , Pett N , Cooke NCA , Brown K , Ramay H et al . Microbiome-derived inosine modulates response to checkpoint inhibitor immunotherapy. Science 2020;369:1481–9.
- Ansaldo E , Belkaid Y . How microbiota improve immunotherapy. Science 2021;373:966–7.
- Ansaldo E , Farley TK , Belkaid Y . Control of immunity by the microbiota. Annu Rev Immunol 2021;39:449–79.
- Zhang Q , Ma C , Duan Y , Heinrich B , Rosato U , Diggs LP et al . Gut microbiome directs hepatocytes to recruit MDSCs and promote cholangiocarcinoma. Cancer Discov 2021;11:1248–67.
- Ding T , Schloss PD . Dynamics and associations of microbial community types across the human body. Nature 2014;509:357–60.
- Byrd AL , Liu M , Fujimura KE , Lyalina S , Nagarkar DR , Charbit B et al . Gut microbiome stability and dynamics in healthy donors and patients with non-gastrointestinal cancers. J Exp Med 2021;218:e20200606.
- Healy CM , Moran GP . The microbiome and oral cancer: more questions than answers. Oral Oncol 2019;89:30-3.
- Swaney MH , Kalan LR . Living in your skin: microbes, molecules and mechanisms. Infect Immun 2021;89:e00695–20.
- Willis JR , Gabaldón T . The human oral microbiome in health and disease: from sequences to ecosystems. Microorganisms 2020;8:308.
- Xu J , Peng J-J , Yang W , Fu K , Zhang Y . Vaginal microbiomes and ovarian cancer: a review. Am J Cancer Res 2020;10:743–56.
- Nejman D , Livyatan I , Fuks G , Gavert N , Zwang Y , Geller LT et al . The human tumor microbiome is composed of tumor type-specific intracellular bacteria. Science 2020;368:973–80.
- Jin C , Lagoudas GK , Zhao C , Bullman S , Bhutkar A , Hu B et al . Commensal microbiota promote lung cancer development via γδ T cells. Cell 2019;176:998–1013.
- Pushalkar S , Hundeyin M , Daley D , Zambirinis CP , Kurz E , Mishra A et al . The pancreatic cancer microbiome promotes oncogenesis by induction of innate and adaptive immune suppression. Cancer Discov 2018;8:403–16.
- McAllister F , Khan MAW , Helmink B , Wargo JA . The tumor microbiome in pancreatic cancer: bacteria and beyond. Cancer Cell 2019;36:577–9.
- Kadosh E , Snir-Alkalay I , Venkatachalam A , May S , Lasry A , Elyada E et al . The gut microbiome switches mutant p53 from tumour-suppressive to oncogenic. Nature 2020;586:133–8.
- Birch J , Gil J . Senescence and the SASP: many therapeutic avenues. Genes Dev 2020;34:1565–76.
- Faget DV , Ren Q , Stewart SA . Unmasking senescence: context-dependent effects of SASP in cancer. Nat Rev Cancer 2019;19:439–53.
- Gorgoulis V , Adams PD , Alimonti A , Bennett DC , Bischof O , Bishop C et al . Cellular senescence: defining a path forward. Cell 2019;179:813–27.
- He S , Sharpless NE . Senescence in health and disease. Cell 2017;169:1000–11.
- Kowald A , Passos JF , Kirkwood TBL . On the evolution of cellular senescence. Aging Cell 2020;19:e13270.
- Lee S , Schmitt CA . The dynamic nature of senescence in cancer. Nat Cell Biol 2019;21:94–101.
- Wang B , Kohli J , Demaria M . Senescent cells in cancer therapy: friends or foes? Trends Cancer 2020;6:838–57.
- Baker DJ , Childs BG , Durik M , Wijers ME , Sieben CJ , Zhong J et al . Naturally occurring p16(Ink4a)-positive cells shorten healthy lifespan. Nature 2016;530:184–9.
- Ruhland MK , Loza AJ , Capietto A-H , Luo X , Knolhoff BL , Flanagan KC et al . Stromal senescence establishes an immunosuppressive microenvironment that drives tumorigenesis. Nat Commun 2016;7:11762.
- Hwang HJ , Lee Y-R , Kang D , Lee HC , Seo HR , Ryu J-K et al . Endothelial cells under therapy-induced senescence secrete CXCL11, which increases aggressiveness of breast cancer cells. Cancer Lett 2020;490:100–10.
- Wang D , Xiao F , Feng Z , Li M , Kong L , Huang L et al . Sunitinib facilitates metastatic breast cancer spreading by inducing endothelial cell senescence. Breast Cancer Res 2020;22:103.
- Amor C , Feucht J , Leibold J , Ho Y-J , Zhu C , Alonso-Curbelo D et al . Senolytic CAR T cells reverse senescence-associated pathologies. Nature 2020;583:127–32.
- Aster JC , Pear WS , Blacklow SC . The varied roles of notch in cancer. Annu Rev Pathol 2017;12:245–75.
- Kuczynski EA , Vermeulen PB , Pezzella F , Kerbel RS , Reynolds AR . Vessel co-option in cancer. Nat Rev Clin Oncol 2019;16:469–93.
Google ScholarCrossref

 Suche
Suche
 Mein Konto
Mein Konto
