Kenmerken van kanker: nieuwe dimensies
Voorwoord The Hallmarks of Cancer Conceptualization is een heuristisch hulpmiddel om de enorme complexiteit van kankerfenotypes en genotypen te destilleren in een voorlopige reeks onderliggende principes. Naarmate de kennis over kankermechanismen is toegenomen, zijn andere facetten van de ziekte naar voren gekomen als mogelijke verfijningen. Dit roept het vooruitzicht op dat fenotypische plasticiteit en ongeordende differentiatie een duidelijk karakteristiek vermogen zijn, en dat niet-mutationele epigenetische herprogrammering en polymorfe microbiomen beide karakteristieke eigenschappen vertegenwoordigen die de verwerving van karakteristieke vaardigheden vergemakkelijken. Bovendien kunnen verouderde cellen van verschillende oorsprong worden toegevoegd aan de lijst van functioneel belangrijke celtypen in de micro-omgeving van de tumor. Dit betekent dat kanker eng is in...

Kenmerken van kanker: nieuwe dimensies
Voorwoord
De Hallmarks of Cancer Conceptualization is een heuristisch hulpmiddel om de enorme complexiteit van kankerfenotypes en genotypen te distilleren in een voorlopige reeks onderliggende principes. Naarmate de kennis over kankermechanismen is toegenomen, zijn andere facetten van de ziekte naar voren gekomen als mogelijke verfijningen. Dit roept het vooruitzicht op dat fenotypische plasticiteit en ongeordende differentiatie een duidelijk karakteristiek vermogen zijn, en dat niet-mutationele epigenetische herprogrammering en polymorfe microbiomen beide karakteristieke eigenschappen vertegenwoordigen die de verwerving van karakteristieke vaardigheden vergemakkelijken. Bovendien kunnen verouderde cellen van verschillende oorsprong worden toegevoegd aan de lijst van functioneel belangrijke celtypen in de micro-omgeving van de tumor.
Betekenis
Kanker is beangstigend vanwege de breedte en reikwijdte van zijn diversiteit, die genetica, cel- en weefselbiologie, pathologie en respons op therapie omvat. Steeds krachtigere experimentele en computationele hulpmiddelen en technologieën zorgen voor een lawine van ‘big data’ over de talloze ziekteverschijnselen die kanker omvat. Het integratieve concept, belichaamd in de kenmerken van kanker, helpt deze complexiteit te destilleren tot een steeds logischere wetenschap, en de voorlopige nieuwe dimensies die in dit perspectief worden gepresenteerd, kunnen waarde toevoegen aan dit streven om de mechanismen van carcinogenese en kwaadaardige progressie beter te begrijpen en deze kennis toe te passen op de kankergeneeskunde.
invoering
De Hallmarks of Cancer zijn voorgesteld als een reeks functionele capaciteiten die menselijke cellen verwerven als ze van een normale naar een neoplastische groeitoestand overgaan, meer specifiek capaciteiten die cruciaal zijn voor hun vermogen om kwaadaardige tumoren te vormen. In deze artikelen ( 1, 2 ), hebben Bob Weinberg en ik een lijst gemaakt van wat wij voor ogen hadden als overeenkomsten die alle soorten kankercellen verenigen op het niveau van het cellulaire fenotype. De bedoeling was om een conceptueel raamwerk te bieden waarmee de complexe fenotypes van diverse menselijke tumortypen en varianten kunnen worden gerationaliseerd in relatie tot een gemeenschappelijke reeks onderliggende cellulaire parameters. Aanvankelijk hadden we de complementaire opname van zes verschillende merkmogelijkheden voor ogen, maar dit aantal werd later uitgebreid naar acht.
Deze formulering werd beïnvloed door de erkenning dat kanker bij de mens zich ontwikkelt als product van meerstapsprocessen en dat de verwerving van deze functionele vermogens op de een of andere manier kan worden toegeschreven aan de verschillende stappen van tumorpathogenese. De diversiteit van kwaadaardige pathogenese, die meerdere tumortypen en een toenemende overvloed aan subtypen omvat, brengt verschillende afwijkingen met zich mee (en dus verworven vaardigheden en eigenschappen) die het resultaat zijn van weefselspecifieke barrières die noodzakelijkerwijs worden omzeild tijdens bepaalde tumorigeneseroutes. Hoewel we erkennen dat dergelijke gespecialiseerde mechanismen nuttig kunnen zijn, hebben we de aanduiding van de kenmerken beperkt tot parameters die een brede impact hebben over het hele spectrum van menselijke kankers.
De acht kenmerken omvatten momenteel (Fig. 1, links) het verworven vermogen om proliferatieve signalering in stand te houden, groeionderdrukkers te vermijden, celdood te weerstaan, replicatieve onsterfelijkheid mogelijk te maken, bloedvaten te induceren/toegang te verkrijgen, invasie en metastase te activeren, het cellulaire metabolisme te herprogrammeren en vernietiging van het immuunsysteem te voorkomen. In de meest recente uitwerking van dit concept (2) werden deregulering van het cellulaire metabolisme en het vermijden van vernietiging van het immuunsysteem afgebakend als ‘opkomende kenmerken’, maar nu, elf jaar later, is het duidelijk dat ze, net als de oorspronkelijke zes, kunnen worden beschouwd als kernkenmerken van kanker en als zodanig zijn opgenomen in het huidige verhaal (Fig. 1, links).
Figuur 1
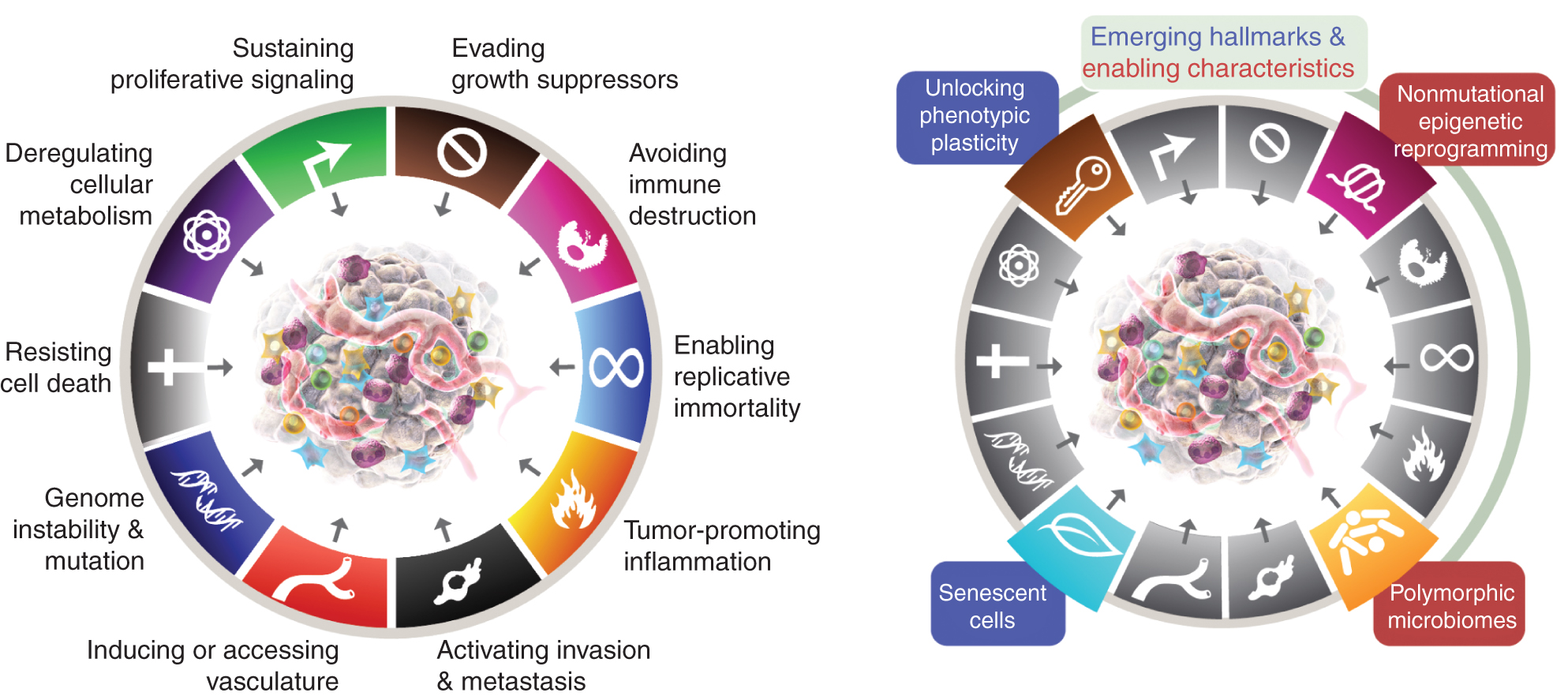
De kenmerken van Kreeft belichamen momenteel acht onderscheidende vaardigheden en twee ondersteunende kwaliteiten. Naast de zes verworven capaciteiten – kenmerken van kanker – die in 2000 werden voorgesteld (1), zijn de twee voorlopige ‘opkomende kenmerken’ die in 2011 werden geïntroduceerd (2) – cellulaire energie (nu beter bekend als ‘herprogrammering van het cellulaire metabolisme’) en ‘het vermijden van immuunvernietiging’ – voldoende gevalideerd om als onderdeel van de kernset te worden beschouwd.
Gegeven de groeiende erkenning dat tumoren adequaat kunnen worden gevasculariseerd, hetzij door het inschakelen van angiogenese, hetzij door het overnemen van normale weefselvasculatuur (128), wordt dit kenmerk ook breder gedefinieerd als het vermogen om vasculatuur te induceren of anderszins te benaderen die de tumorgroei ondersteunt, voornamelijk door invasie en metastase.
Het vervolg uit 2011 omvatte ook ‘tumorbevorderende ontstekingen’ als een tweede faciliterende eigenschap, als aanvulling op de overkoepelende ‘genoominstabiliteit en mutatie’, die samen fundamenteel betrokken waren bij het activeren van de acht kenmerkende (functionele) vermogens die nodig zijn voor tumorgroei en -progressie. Het is waar dat deze review aanvullende voorgestelde nieuwe kenmerken en mogelijkheden bevat, waaronder ‘het ontsluiten van fenotypische plasticiteit’, ‘niet-mutationele epigenetische herprogrammering’, ‘polymorfe microbiomen’ en ‘senescente cellen’. De handelsmerken van de kankerafbeelding zijn overgenomen van Hanahan en Weinberg (2).
Zoals we destijds opmerkten, kunnen deze onderscheidende kenmerken op zich niet de complexiteit van de pathogenese van kanker aanpakken, d.w.z. h. de precieze moleculaire en cellulaire mechanismen die ervoor zorgen dat de zich ontwikkelende preneoplastische cellen deze afwijkende fenotypische vermogens kunnen ontwikkelen en verwerven tijdens het verloop van tumorigenese en kwaadaardige progressie.
Dienovereenkomstig hebben we een ander concept aan de discussie toegevoegd dat wordt gepresenteerd als ‘mogelijk makende kenmerken’, gevolgen van de afwijkende toestand van het neoplasma die de middelen verschaffen waarmee kankercellen en tumoren deze functionele kenmerken kunnen verkrijgen. Als zodanig worden de faciliterende eigenschappen weerspiegeld in moleculaire en cellulaire mechanismen waarmee kenmerken worden verworven, in plaats van in de bovengenoemde acht vaardigheden zelf. Deze twee activeringsprocessen waren genoominstabiliteit en tumorbevorderende ontstekingen.
We erkenden verder dat de tumormicro-omgeving (TME), hierin gedefinieerd als samengesteld uit heterogene en interactieve populaties van kankercellen en kankerstamcellen samen met een verscheidenheid aan gerecruteerde stromale celtypen – het getransformeerde parenchym en het bijbehorende stroma – nu algemeen wordt gewaardeerd als een essentiële rol bij tumorigenese en kwaadaardige progressie.
Gezien de voortdurende belangstelling voor deze formuleringen en onze voortdurende intentie om voortdurende discussie en verfijning van het Hallmarks-schema aan te moedigen, is het passend om een veelgestelde vraag te overwegen: Zijn er aanvullende kenmerken van dit conceptuele model die kunnen worden opgenomen, rekening houdend met de noodzaak om dit te garanderen? dat ze breed toepasbaar zijn in het hele spectrum van menselijke kankers? Dienovereenkomstig presenteer ik verschillende potentiële nieuwe kenmerken en faciliterende kenmerken die te zijner tijd zouden kunnen worden geïntegreerd als kerncomponenten van de kenmerken van de conceptualisering van kanker.
Deze parameters zijn ‘het ontsluiten van fenotypische plasticiteit’, ‘niet-mutationele epigenetische herprogrammering’, ‘polymorfe microbiomen’ en ‘senescente cellen’ (Fig. 1, rechts). Belangrijk is dat de voorbeelden die ter ondersteuning van deze stellingen worden gepresenteerd illustratief zijn, maar geenszins alomvattend, aangezien er een groeiende en steeds overtuigender hoeveelheid gepubliceerd bewijsmateriaal is om elk vignet te ondersteunen.
Het aanboren van fenotypische plasticiteit
Tijdens de organogenese gaat de ontwikkeling, bepaling en organisatie van cellen in weefsels om homeostatische functies uit te voeren gepaard met terminale differentiatie, waarbij voorlopercellen ophouden te groeien, soms onomkeerbaar, naarmate deze processen hun hoogtepunt bereiken. Als zodanig is het eindresultaat van cellulaire differentiatie in de meeste gevallen antiproliferatief en vormt het een duidelijke barrière voor voortdurende proliferatie die noodzakelijk is voor neoplasie.
Er is steeds meer bewijs dat het ontsluiten van het normaal beperkte vermogen van fenotypische plasticiteit om de toestand van terminale differentiatie te omzeilen of te ontsnappen een cruciaal onderdeel is van de pathogenese van kanker (3). Deze plasticiteit kan in verschillende verschijningsvormen optreden (Fig. 2). Opkomende kankercellen die afkomstig zijn van een normale cel die is geëvolueerd langs een pad dat een volledig gedifferentieerde toestand benadert of aanneemt, kunnen dus van koers veranderen door terug te dedifferentiëren naar voorloperachtige celtoestanden.
Omgekeerd kunnen neoplastische cellen die voortkomen uit een voorlopercel die voorbestemd is om een pad te volgen dat leidt tot terminale differentiatie, het proces kortsluiten en de zich uitbreidende kankercellen in een gedeeltelijk gedifferentieerde, voorloperachtige staat houden. Als alternatief kan transdifferentiatie optreden waarbij cellen die oorspronkelijk aan één differentiatieroute waren toegewijd, overschakelen naar een compleet ander ontwikkelingsprogramma en daardoor weefselspecifieke kenmerken verwerven die niet vooraf werden bepaald door hun normale cellen van oorsprong.
De volgende voorbeelden ondersteunen het argument dat verschillende vormen van cellulaire plasticiteit fenotypische plasticiteit onthullen. Aan de linkerkant is fenotypische plasticiteit aantoonbaar een verworven karakteristiek vermogen dat verschillende verstoringen van celdifferentiatie mogelijk maakt, waaronder (i) dedifferentiatie van volwassen naar voorlopercellen, (ii) vastgelopen (terminale) differentiatie van voorlopercellen, en (iii) transdifferentiatie naar andere cellijnen. Aan de rechterkant worden drie prominente vormen van verminderde differentiatie weergegeven die een integraal onderdeel zijn van de pathogenese van kanker.
Door de normale differentiatie van voorlopercellen in volwassen cellen in ontwikkelingslijnen op differentiële wijze te verstoren, worden tumorigenese en kwaadaardige progressie die voortkomt uit cellen van oorsprong in dergelijke routes vergemakkelijkt. De handelsmerken van de kankerafbeelding zijn overgenomen van Hanahan en Weinberg (2).
Figuur 2

Dedifferentiatie
Coloncarcinogenese is een voorbeeld van verminderde differentiatie, aangezien er een teleologische behoefte bestaat aan beginnende kankercellen om te ontsnappen aan de lopende band van terminale differentiatie en exfoliatie, wat in principe zou kunnen gebeuren door dedifferentiatie van colonepitheelcellen die nog niet terminaal gedifferentieerd zijn of door vastgelopen differentiatie van voorlopercellen/stamcellen in de crypten die aanleiding geven tot deze differentiërende cellen. Zowel gedifferentieerde cellen als stamcellen zijn betrokken als oorsprongscellen voor darmkanker (4 – 6).
Twee ontwikkelingstranscriptiefactoren (TF), het homeobox-eiwit HOXA5 en SMAD4, de laatste betrokken bij BMP-signalering, komen in hoge mate tot expressie in differentiërende colonepitheelcellen en gaan doorgaans verloren in gevorderde coloncarcinomen, die kenmerkend markers van stam- en voorlopercellen tot expressie brengen. Functionele verstoringen in muismodellen hebben aangetoond dat geforceerde expressie van HOXA5 in darmkankercellen differentiatiemarkers herstelt, stamcelfenotypes onderdrukt en invasie en metastase schaadt, wat een reden biedt voor de karakteristieke downregulatie ervan (7, 8).
SMAD4 daarentegen dwingt zowel differentiatie als onderdrukking van proliferatie af, aangedreven door oncogene WNT-signalering, wat wordt onthuld door het kunstmatige verlies van SMAD4-expressie, wat een verklaring biedt voor het verlies van expressie om dedifferentiatie en vervolgens WNT-aangedreven hyperproliferatie mogelijk te maken (5).
Opvallend is dat het verlies van deze twee ‘differentiatie-onderdrukkers’, met de daaruit voortvloeiende dedifferentiatie, gepaard gaat met de verwerving van andere kenmerkende capaciteiten, evenals van andere kenmerkende regulatoren, wat de strikte definitie van dit voorlopige kenmerk als scheidbaar en onafhankelijk compliceert.
Een andere bewijslijn betreft de onderdrukte expressie van de MITF-masterregulator van melanocytdifferentiatie, die betrokken lijkt te zijn bij het ontstaan van agressieve vormen van kwaadaardig melanoom. Verlies van deze ontwikkelings-TF wordt geassocieerd met reactivering van neurale voorlopergenen en downregulatie van genen die volledig gedifferentieerde melanocyten karakteriseren. Het opnieuw verschijnen van de neurale lijstgenen geeft aan dat deze cellen terugkeren naar de voorloperstaat waaruit melanocyten tijdens de ontwikkeling voortkomen.
Bovendien heeft een afstammingsonderzoek van door BRAF geïnduceerde melanomen aangetoond dat volwassen gepigmenteerde melanocyten de oorspronkelijke cellen zijn die dedifferentiatie ondergaan tijdens het verloop van de tumorigenese (9). Met name het mutante BRAF-oncogen, dat in meer dan de helft van de huidmelanomen wordt aangetroffen, induceert hyperproliferatie, die voorafgaat aan en daarom mechanistisch kan worden gescheiden van de daaropvolgende dedifferentiatie die voortkomt uit de downregulatie van MITF.
Een ander onderzoek impliceerde functioneel de opregulatie van de ontwikkelings-TF ATF2, waarvan de karakteristieke expressie in muizen- en menselijke melanomen MITF1 indirect onderdrukt, gelijktijdig met kwaadaardige progressie van de dientengevolge gededifferentieerde melanoomcellen (10). Omgekeerd resulteert expressie in melanomen van mutante vormen van ATF2 die MITF niet kunnen onderdrukken, in goed gedifferentieerde melanomen (11).
Bovendien heeft een recente studie (12) dedifferentiatie van de afstamming in verband gebracht met kwaadaardige progressie van pancreaseilandcelneoplasma's naar metastasegevoelige carcinomen; deze neuro-endocriene cellen en afgeleide tumoren komen voort uit een ontwikkelingslijn die verschilt van die welke het veel grotere aantal aangrenzende cellen genereert die het exocriene en pancreas vormen en de resulterende ductale adenocarcinomen.
Opmerkelijk is dat de uit meerdere stappen bestaande differentiatieroute van voorlopercellen van eilandjes naar volwassen β-cellen grondig is gekarakteriseerd (13). Vergelijkende transcriptoomprofilering laat zien dat adenoomachtige eilandtumoren het meest lijken op onrijpe maar gedifferentieerde insulineproducerende β-cellen, terwijl de invasieve carcinomen het meest lijken op embryonale voorlopers van eilandcellen. Progressie naar slecht gedifferentieerde carcinomen omvat een eerste stap van dedifferentiatie, die aanvankelijk geen verhoogde proliferatie of verminderde apoptose met zich meebrengt in vergelijking met goed gedifferentieerde adenomen, die beide later optreden.
De discrete stap van dedifferentiatie wordt dus niet aangedreven door waarneembare veranderingen in de karakteristieke kenmerken van aanhoudende proliferatie en resistentie tegen apoptose. In plaats daarvan is de opregulatie van een miRNA dat voorheen betrokken was bij het specificeren van de voorloperstatus van het eilandje er een die wordt gedownreguleerd tijdens terminale differentiatie van β-cellen, 12).
Geblokkeerde differentiatie
Hoewel de bovenstaande voorbeelden illustreren hoe onderdrukking van expressie van differentiatiefactoren tumorigenese kan vergemakkelijken door beter gedifferentieerde cellen te dedifferentiëren tot voorlopercellen, kunnen in andere gevallen onvolledig gedifferentieerde voorlopercellen te maken krijgen met veranderingen in de regelgeving die hun verdere progressie naar volledig gedifferentieerde, doorgaans niet-proliferatieve toestanden actief blokkeren.
Het is al lang gedocumenteerd dat acute promyelocytische leukemie (APL) het gevolg is van een chromosomale translocatie die de PML-locus fuseert met het gen dat codeert voor de retinoïnezuur-α-nucleaire receptor (RARα). Myeloïde voorlopercellen die dergelijke translocaties dragen, zijn blijkbaar niet in staat hun gebruikelijke terminale differentiatie tot granulocyten voort te zetten, wat resulteert in cellen die gevangen zitten in een proliferatief, promyelocytachtig voorloperstadium (14).
Het proof of concept voor dit schema is afkomstig van de behandeling van gekweekte APL-cellen, muismodellen van de ziekte en getroffen patiënten met retinoïnezuur, de ligand van RARα; Deze therapeutische behandeling zorgt ervoor dat de neoplastische APL-cellen differentiëren tot ogenschijnlijk volwassen, niet-prolifererende granulocyten, waardoor hun progressieve proliferatieve expansie wordt kortgesloten (14-16).
Een variatie op dit thema betreft een andere vorm van acute myeloïde leukemie, waarbij deze de t(8;21)-translocatie draagt die het AML1-ETO-fusie-eiwit produceert. Dit eiwit alleen kan myeloïde voorlopercellen transformeren, althans gedeeltelijk door hun differentiatie te blokkeren. Therapeutische interventie in muismodellen en patiënten met een farmacologische remmer van een chromatine-modificerend histondeacetylase (HDAC) zorgt ervoor dat myeloïde leukemiecellen de differentiatie hervatten in cellen met een meer volwassen myeloïde celmorfologie. Deze reactie gaat gepaard met een vermindering van het proliferatieve vermogen, waardoor de progressie van deze leukemie wordt belemmerd (17, 18).
Een derde voorbeeld bij melanoom betreft een ontwikkelings-TF, SOX10, die normaal gesproken wordt gedownreguleerd tijdens de differentiatie van melanocyten. Onderzoek naar winst- en verliesfunctie in een zebravismodel van door BRAF geïnduceerde melanomen heeft aangetoond dat abnormaal gehandhaafde expressie van SOX10 de differentiatie van neurale voorlopercellen in melanocyten blokkeert, waardoor de vorming van door BRAF aangestuurde melanomen mogelijk wordt gemaakt (19).
Andere voorbeelden van differentiatiemodulatoren zijn onder meer de metaboliet alfa-ketoglutaraat (αKG), een noodzakelijke cofactor voor een aantal chromatine-modificerende enzymen waarvan is aangetoond dat ze betrokken zijn bij het stimuleren van bepaalde gedifferentieerde celtoestanden. Bij pancreaskanker stimuleert de tumorsuppressor p53 de productie van αKG en het behoud van een meer gedifferentieerde celtoestand, terwijl een prototypisch verlies van p53-functie leidt tot een verlaging van de αKG-niveaus en daaruit voortvloeiende dedifferentiatie, wat geassocieerd is met kwaadaardige progressie (20).
Bij één vorm van leverkanker resulteert de mutatie van een isocitraatdehydrogenase-gen (IDH1/2) niet in de productie van differentiatie-inducerende αKG, maar eerder in een verwante “oncometaboliet”, D-2-hydroxygluteraat (D2HG), waarvan is aangetoond dat het de hepatocytdifferentiatie van levervoorlopercellen blokkeert door middel van D2HG-gemedieerde repressie van een hoofdregulator van hepatocytdifferentiatie en rust. HNF4a.
D2HG-gemedieerde onderdrukking van de HNF4a-functie veroorzaakt een proliferatieve expansie van hepatocytvoorlopercellen in de lever, die vatbaar worden voor oncogene transformatie bij daaropvolgende mutatieactivering van het KRAS-oncogen, wat kwaadaardige progressie naar cholangiocarcinoom van de lever veroorzaakt (21). De IDH1/2-mutant en zijn oncometaboliet D2HG functioneren ook in een verscheidenheid aan myeloïde en andere solide tumortypen, waarbij D2HG αKG-afhankelijke dioxygenasen remt die nodig zijn voor histon- en DNA-methyleringsgebeurtenissen die veranderingen in de chromatinestructuur mediëren tijdens differentiatie van de ontwikkelingslijn, waardoor het begin van kankercellen in een voorloperstatus wordt bevroren (22, 23).
Een aanvullend, gerelateerd concept is ‘omzeilde differentiatie’, waarbij gedeeltelijk of ongedifferentieerde voorlopercellen/stamcellen de celcyclus verlaten en in beschermende niches blijven liggen, met het potentieel om proliferatieve expansie opnieuw te initiëren (24), hoewel nog steeds met de selectieve druk om hun geprogrammeerde differentiatie op de een of andere manier te verstoren.
Transdifferentiatie
Het concept van transdifferentiatie wordt al lang door pathologen erkend in de vorm van weefselmetaplasie, waarbij cellen van een bepaald gedifferentieerd fenotype hun morfologie aanzienlijk veranderen om duidelijk herkenbaar te worden als elementen van een ander weefsel. Een prominent voorbeeld hiervan is de slokdarm van Barrett, waar chronische ontsteking van het gelaagde plaveiselepitheel van de slokdarm transdifferentiatie induceert naar een eenvoudig kolomvormig epitheel dat kenmerkend is voor de darm, waardoor de daaropvolgende ontwikkeling van adenocarcinomen in plaats van de plaveiselcelcarcinomen die van dit plaveiselepitheel worden verwacht (3).
Nu onthullen moleculaire determinanten mechanismen van transdifferentiatie bij verschillende vormen van kanker, zowel voor gevallen waarin grove weefselmetaplasie duidelijk is als voor gevallen waarin deze wat subtieler is, zoals de volgende voorbeelden illustreren.
Een informatief argument voor transdifferentiatie als een discrete gebeurtenis bij tumorigenese betreft ductaal adenocarcinoom van de pancreas (PDAC), waarbij een van de betrokken cellen van oorsprong, de acinaire cel van de pancreas, kan transdifferentiëren naar een ductaal celfenotype tijdens de initiatie van neoplastische ontwikkeling. Twee TF’s – PTF1a en MIST1 – controleren de specificatie en het onderhoud van de gedifferentieerde acinaire celtoestand van de pancreas via hun expressie in de context van zichzelf in stand houdende “feed-forward” regulerende lussen (25).
Beide TF's worden vaak gedownreguleerd tijdens neoplastische ontwikkeling en kwaadaardige progressie van PDAC bij mens en muis. Functioneel genetisch onderzoek bij muizen en gekweekte menselijke PDAC-cellen heeft aangetoond dat experimenteel geforceerde expressie van PTF1a de door KRAS geïnduceerde transdifferentiatie en proliferatie schaadt en ook de herdifferentiatie van reeds neoplastische cellen naar een rustig acinair celfenotype kan forceren (26).
Omgekeerd veroorzaakt onderdrukking van PTF1a-expressie acinaire-naar-duct-metaplasie, namelijk transdifferentiatie, en maakt daardoor de kanaalachtige cellen gevoelig voor oncogene KRAS-transformatie, waardoor de daaropvolgende ontwikkeling van invasieve PDAC wordt versneld (27). Op dezelfde manier blokkeert geforceerde expressie van MIST1 in de pancreas die KRAS tot expressie brengt ook de transdifferentiatie en schaadt het de initiatie van pancreastumorigenese, die anders wordt vergemakkelijkt door de vorming van premaligne ductachtige (PanIN) laesies, terwijl genetische deletie van MIST1 de vorming ervan en de initiatie van KRAS-aangedreven neoplastische progressie verbetert (28).
Verlies van PTF1- of MIST1-expressie tijdens tumorigenese wordt geassocieerd met verhoogde expressie van een andere ontwikkelingsregulerende TF, SOX9, die normaal gesproken effectief is bij de specificatie van ductale cellen (27, 28). Geforceerde opregulatie van SOX9, waardoor de noodzaak voor downregulatie van PTF1a wordt vermeden, en van MIST1 is ook aangetoond dat het de transdifferentiatie van acinaire cellen naar een ductaal celfenotype stimuleert dat gevoelig is voor door KRAS geïnduceerde neoplasie (29), wat impliceert dat SOX9 een belangrijke functionele effector is van hun downregulatie in het ontstaan van menselijke PDAC.
Drie TF's die de pancreasdifferentiatie reguleren kunnen dus op verschillende manieren worden gewijzigd om een getransdifferentieerde toestand te induceren die, in de context van mutatieactivatie van KRAS, oncogene transformatie en de initiatie van tumorigenese en kwaadaardige progressie vergemakkelijkt.
Bijkomende leden van de SOX-familie van chromatine-geassocieerde regulerende factoren zijn enerzijds grotendeels geassocieerd met zowel de specificatie van het lot van de cellen als het wisselen van afstammingslijnen in de ontwikkeling (30) en anderzijds met verschillende tumor-geassocieerde fenotypes (31). Een ander prominent voorbeeld van door SOX gemedieerde transdifferentiatie betreft een mechanisme van therapeutische resistentie bij prostaatkanker.
In dit geval is het verlies van de RB- en p53-tumorsuppressoren – waarvan de afwezigheid kenmerkend is voor neuro-endocriene tumoren – als reactie op antiandrogeentherapie noodzakelijk maar niet voldoende voor de algemeen waargenomen transformatie van goed gedifferentieerde prostaatkankercellen in carcinoomcellen die de differentiatielijn zijn binnengedrongen met moleculaire en histologische kenmerken van neuro-endocriene cellen die in het bijzonder de androgeenreceptor niet tot expressie brengen. Naast het verlies van RB en p53 vereist verworven resistentie tegen antiandrogeentherapie een verhoogde expressie van SOX2, een ontwikkelingsregulerend gen waarvan is aangetoond dat het helpt bij het induceren van transdifferentiatie van de op therapie reagerende adenocarcinoomcellen in derivaten die zich in een neuro-endocriene celtoestand bevinden die ongevoelig is voor therapie (32).
Een derde voorbeeld toont ook transdifferentiatie als een strategie die door carcinoomcellen wordt gebruikt om eliminatie door lijnspecifieke therapie te voorkomen, in dit geval met basaalcelcarcinomen (BCC's) van de huid die zijn behandeld met een farmacologische remmer van de Hedgehog-Smoothened (HH/SMO) oncogene route waarvan bekend is dat deze de neoplastische groei van deze cellen aanstuurt (33).
Geneesmiddelresistente kankercellen schakelen over naar een ontwikkelingsgerelateerd maar verschillend celtype via brede epigenetische verschuivingen in specifieke chromatinedomeinen en veranderde toegankelijkheid van twee superversterkers. De nieuw verworven fenotypische toestand van BCC-cellen stelt hen in staat de expressie van de oncogene WNT-signaleringsroute te behouden, wat op zijn beurt onafhankelijkheid van de door geneesmiddelen onderdrukte HH/SMO-signaleringsroute verleent (34).
Zoals verwacht uit deze transdifferentiatie verschuift het transcriptoom van de kankercellen van een gensignatuur die de betrokken cel van herkomst van BCC's weerspiegelt, namelijk de stamcellen van de haarzakjes, naar een signatuur die indicatief is voor de basale stamcellen die de interfolliculaire epidermis van BCC bevolken. Een dergelijke transdifferentiatie om resistentie tegen geneesmiddelen mogelijk te maken, wordt steeds vaker gedocumenteerd bij verschillende vormen van kanker (35).
Plasticiteit uit de ontwikkelingslijn lijkt ook overheersend te zijn bij de belangrijkste subtypes van longcarcinoom, d.w.z. h. bij neuro-endocriene carcinomen [kleincellige longkanker (SCLC)] en adenocarcinomen + plaveiselcelcarcinomen [collectieve niet-kleincellige longkanker (NSCLC)]. Single-cell RNA-sequencing heeft een opmerkelijk dynamische en heterogene conversie tussen deze subtypen aan het licht gebracht, evenals duidelijke variaties daarin, tijdens de stadia van longtumorigenese, daaropvolgende kwaadaardige progressie en respons op therapie (36 – 38).
Daarom schetsen deze onderzoeken, in plaats van de simpele conceptualisering van een pure klonale omschakeling van de ene naar de andere afstammingslijn, een veel complexer beeld van dynamisch onderling omzettende subpopulaties van kankercellen die kenmerken vertonen van meerdere ontwikkelingslijnen en differentiatiestadia, een ontnuchterend inzicht in dit opzicht voor op afstamming gebaseerde therapeutische targeting van menselijke longkanker. Regulerende determinanten van deze dynamische fenotypische plasticiteit beginnen te worden geïdentificeerd (37, 39, 40).
Samenvatting
De drie hierboven beschreven klassen van mechanismen benadrukken selectieve regulatoren van cellulaire plasticiteit die – althans gedeeltelijk – te scheiden zijn van de belangrijkste oncogene factoren en andere onderscheidende capaciteiten. Naast deze voorbeelden is er een aanzienlijke hoeveelheid bewijsmateriaal dat vele vormen van kanker in verband brengt met verminderde differentiatie, wat gepaard gaat met de verwerving van transcriptoomsignaturen en andere fenotypes - bijvoorbeeld histologische morfologie - die geassocieerd zijn met voorloper- of stamcelstadia die worden waargenomen in de overeenkomstige normale weefsels. oorsprong of in andere, verder verwante celtypen en afstammingslijnen (41 – 43).
Als zodanig lijken deze drie subklassen van fenotypische plasticiteit – dedifferentiatie van volwassen cellen terug naar voorlopercellen, vastgelopen differentiatie om zich ontwikkelende cellen in voorloper-/stamceltoestanden te bevriezen, en transdifferentiatie naar alternatieve cellijnen – effectief te zijn bij verschillende soorten kanker tijdens primaire tumorigenese, kwaadaardige progressie en/of respons op therapie.
Er zijn echter twee conceptuele overwegingen. Ten eerste zijn dedifferentiatie en vastgelopen differentiatie waarschijnlijk met elkaar verweven, omdat ze niet van elkaar te onderscheiden zijn bij veel tumortypen waarbij de cel van oorsprong – gedifferentieerde cel of voorlopercel/stamcel – onbekend is of er op een andere manier bij betrokken is. Ten tweede is de verwerving of het behoud van fenotypes van voorlopercellen en het verlies van gedifferentieerde kenmerken in de meeste gevallen een onnauwkeurige weerspiegeling van het normale ontwikkelingsstadium, ondergedompeld in een milieu van andere karakteristieke veranderingen in de kankercel die niet aanwezig zijn in zich natuurlijk ontwikkelende cellen.
Bovendien omvat een andere vorm van fenotypische plasticiteit cellulaire veroudering, die hieronder meer in het algemeen wordt besproken, waarbij kankercellen die worden geïnduceerd om schijnbaar onomkeerbare veroudering te ondergaan, in plaats daarvan kunnen ontsnappen en de proliferatieve expansie kunnen voortzetten (44). Ten slotte is cellulaire plasticiteit, net als andere onderscheidende capaciteiten, geen nieuwe uitvinding of afwijking van kankercellen, maar eerder de corruptie van latente maar activeerbare capaciteiten die verschillende normale cellen gebruiken om homeostase, herstel en regeneratie te ondersteunen (45).
Over het geheel genomen moedigen deze illustratieve voorbeelden de overweging aan dat het ontsluiten van cellulaire plasticiteit om verschillende vormen van verstoorde differentiatie mogelijk te maken een duidelijk onderscheidend vermogen vertegenwoordigt dat qua regulatie en cellulair fenotype verschilt van de goed gevalideerde kernkenmerken van kanker (Fig. 2).
Epigenetische herprogrammering zonder mutatie
De faciliterende eigenschap van genoom (DNA) instabiliteit en mutatie is een fundamenteel onderdeel van de ontwikkeling en pathogenese van kanker. Momenteel catalogiseren verschillende internationale consortia mutaties in het genoom van menselijke kankercellen, in vrijwel elk type menselijke kanker, in verschillende stadia van kwaadaardige progressie, inclusief metastatische laesies, en tijdens de ontwikkeling van resistentie tegen adaptieve therapie. Eén resultaat is de nu wijdverbreide erkenning dat mutaties in genen die de chromatine-architectuur organiseren, moduleren en in stand houden en daardoor de genexpressie wereldwijd reguleren, steeds vaker worden ontdekt en functioneel gekoppeld zijn aan kankerkenmerken (46 – 48).
Bovendien zijn er argumenten voor een andere schijnbaar onafhankelijke vorm van genoomherprogrammering die puur epigenetisch gereguleerde veranderingen in genexpressie inhoudt, een vorm die ‘niet-mutationele epigenetische herprogrammering’ zou kunnen worden genoemd (Fig. 3). In feite werd de stelling van de mutatieloze kankerevolutie en de puur epigenetische programmering van karakteristieke kankerfenotypes bijna tien jaar geleden opgeworpen (49) en wordt deze steeds vaker besproken (46, 50-52).
Figuur 3

Vergelijkbaar met wat er gebeurt tijdens embryogenese en weefseldifferentiatie en homeostase, suggereert het verzamelen van bewijsmateriaal dat instrumentele genregulerende circuits en netwerken in tumoren kunnen worden gecontroleerd door een overvloed aan corrupte en gecoöpteerde mechanismen die onafhankelijk zijn van genoominstabiliteit en genmutatie. De handelsmerken van de kankerafbeelding zijn overgenomen van Hanahan en Weinberg (2).
Uiteraard is het concept van niet-mutationele epigenetische regulatie van genexpressie goed ingeburgerd als het centrale mechanisme dat de embryonale ontwikkeling, differentiatie en organogenese bemiddelt (53 – 55). Bij volwassenen omvat het langetermijngeheugen bijvoorbeeld veranderingen in gen- en histonmodificatie, in de chromatinestructuur en in het activeren van genexpressieschakelaars, die in de loop van de tijd stabiel worden gehandhaafd door positieve en negatieve feedbacklussen (56, 57). Toenemend bewijs ondersteunt het idee dat analoge epigenetische veranderingen kunnen bijdragen aan de verwerving van karakteristieke vaardigheden tijdens tumorontwikkeling en kwaadaardige progressie. Om deze hypothese te ondersteunen worden hieronder enkele voorbeelden gegeven.
Micro-omgevingsmechanismen van epigenetische herprogrammering
Hoe wordt het genoom van de kankercel geherprogrammeerd als het niet alleen door oncogene mutaties gebeurt? Een groeiend aantal bewijzen suggereert dat de afwijkende fysieke eigenschappen van de micro-omgeving van de tumor brede veranderingen in het epigenoom kunnen veroorzaken, waarvan veranderingen die gunstig zijn voor de fenotypische selectie van eigenschapsmogelijkheden kunnen leiden tot klonale uitgroei van kankercellen met een verbeterde geschiktheid voor proliferatieve expansie.
Een gemeenschappelijk kenmerk van tumoren (of gebieden binnen tumoren) is hypoxie als gevolg van onvoldoende vascularisatie. Hypoxie vermindert bijvoorbeeld de activiteit van TET-demethylasen, wat leidt tot significante veranderingen in het methyloom, met name hypermethylering (58). Onvoldoende vascularisatie beperkt waarschijnlijk ook de biologische beschikbaarheid van cruciale, door het bloed overgedragen voedingsstoffen, en het is bijvoorbeeld aangetoond dat een tekort aan voedingsstoffen de translationele controle verandert en bijgevolg het kwaadaardige fenotype van borstkankercellen vergroot (59).
Een overtuigend voorbeeld van door hypoxie gemedieerde epigenetische regulatie is een vorm van het altijd fatale ependymoom bij kinderen. Zoals veel embryonale en pediatrische tumoren mist deze vorm terugkerende mutaties, met name een gebrek aan driver-mutaties in oncogenen en tumorsuppressors. In plaats daarvan is aangetoond dat de abnormale groei van deze kankercellen onder controle wordt gehouden door een door hypoxie geïnduceerd genregulerend programma (60, 61). Opmerkelijk is dat de vermoedelijke oorsprongscel van deze kanker zich in een hypoxisch compartiment bevindt en waarschijnlijk de cellen daarin gevoelig maakt om tumorigenese te initiëren via tot nu toe onbekende cofactoren.
Een ander overtuigend bewijs voor door micro-omgeving gemedieerde epigenetische regulatie betreft het invasieve groeivermogen van kankercellen. Een klassiek voorbeeld is de omkeerbare inductie van invasiviteit van kankercellen aan de randen van veel solide tumoren, georkestreerd door het ontwikkelingsregulatieprogramma dat bekend staat als epitheliale naar mesenchymale transitie (EMT; ref. 62-64). Met name is onlangs aangetoond dat een hoofdregulator van EMT, ZEB1, de expressie induceert van een histonmethyltransferase, SETD1B, die op zijn beurt de expressie van ZEB1 in stand houdt in een positieve feedbacklus die de (invasieve) regulerende toestand van EMT in stand houdt (65).
Een eerdere studie documenteerde op vergelijkbare wijze dat inductie van EMT door opgereguleerde expressie van een verwante TF, SNAIL1, duidelijke veranderingen in het chromatinelandschap veroorzaakte als resultaat van de inductie van een aantal chromatinemodificatoren waarvan werd aangetoond dat de activiteit noodzakelijk was voor het behoud van de fenotypische toestand (66). Bovendien kunnen een aantal aandoeningen en factoren die kankercellen aan de randen van tumoren ervaren, waaronder hypoxie en cytokines uitgescheiden door stromacellen, blijkbaar EMT en dus invasiviteit induceren (67, 68).
Een opvallend voorbeeld van het programmeren van invasiviteit door de micro-omgeving, dat vermoedelijk geen verband houdt met het EMT-programma, betreft de autocriene activering van een neuronaal signaalcircuit waarbij uitgescheiden glutamaat en zijn receptor NMDAR betrokken zijn (69, 70). Opmerkelijk genoeg heeft de prototypische stijfheid van veel solide tumoren, belichaamd in uitgebreide veranderingen aan de extracellulaire matrix (ECM) die de cellen daarin omhult, diepgaande implicaties voor de invasieve en andere fenotypische eigenschappen van kankercellen.
Vergeleken met de ECM van normaal weefsel waaruit tumoren ontstaan, wordt de ECM van de tumor doorgaans gekenmerkt door verhoogde verknoping en dichtheid, enzymatische modificaties en veranderde moleculaire samenstelling die gezamenlijk, gedeeltelijk via integrinereceptoren voor ECM-motieven, door stijfheid geïnduceerde signalering en genexpressienetwerken die invasiviteit en andere karakteristieke kenmerken induceren, orkestreren (71).
Naast dergelijke regulerende mechanismen die worden begiftigd door de fysieke micro-omgeving van de tumor, kan paracriene signalering, bestaande uit oplosbare factoren die in het extracellulaire milieu worden vrijgegeven door de verschillende celtypen die solide tumoren bevolken, ook bijdragen aan de inductie van verschillende morfologisch verschillende invasieve groeiprogramma's (72), waarvan er slechts één – ‘mesenchymaal’ genoemd – betrokken lijkt te zijn bij het bovengenoemde epigenetische regulerende mechanisme van EMT.
Epigenetische heterogeniteit in de regelgeving
Een groeiende kennisbasis vergroot de waardering voor het belang van intratumorale heterogeniteit bij het genereren van de fenotypische diversiteit waarbij de meest geschikte cellen voor proliferatieve expansie en invasie hun broeders ontgroeien en daarom worden geselecteerd voor kwaadaardige progressie. Eén facet van deze fenotypische heterogeniteit is zeker te wijten aan chronische of episodische genomische instabiliteit en de daaruit voortvloeiende genetische heterogeniteit in de cellen die een tumor bevolken.
Bovendien wordt het steeds duidelijker dat er mogelijk niet op mutaties gebaseerde epigenetische heterogeniteit bestaat. Een prominent voorbeeld is de linker histon H1.0, die dynamisch tot expressie wordt gebracht en onderdrukt in subpopulaties van kankercellen binnen een reeks tumortypen, met als gevolg sekwestratie of toegankelijkheid van domeinen van megabase-grootte [73]. Met name bleek de populatie kankercellen met onderdrukt H1.0 stamachtige eigenschappen, een verbeterd tumor-initiërend vermogen en een verband met een slechte prognose bij patiënten te vertonen.
Een ander voorbeeld van epigenetisch gereguleerde plasticiteit is beschreven bij menselijke orale plaveiselcelcarcinomen (SCC), waarbij kankercellen aan de invasieve randen een gedeeltelijke EMT-toestand (p-EMT) aannemen die de bovengenoemde mesenchymale TF's mist, maar andere EMT-definiërende genen tot expressie brengt die niet tot expressie komen in de centrale kern van de tumoren (74).
De p-EMT-cellen vertegenwoordigen duidelijk geen klonale compartimentalisatie van door mutatie gewijzigde cellen: kweken van primaire tumor-afgeleide kankercellen bevatten dynamische mengsels van zowel p-EMT hi- als p-EMT lo-cellen en wanneer p-EMT hi/lo-cellen FACS-gezuiverd en gekweekt werden, keerden beide binnen 4 dagen terug naar gemengde populaties van p-EMT hi en p-EMT lo. Hoewel paracriene signalen van het aangrenzende stroma als deterministisch kunnen worden beschouwd voor de p-EMT hi-toestand, pleit de stabiele aanwezigheid en regeneratie van de twee epigenetische toestanden in de cultuur voor een intrinsiek mechanisme van kankercellen. Deze conclusie wordt met name ondersteund door de analyse van 198 cellijnen die 22 soorten kanker vertegenwoordigen, waaronder SCC, waarbij 12 stabiel heterogene epigenetische toestanden (inclusief de p-EMT in SCC) op verschillende manieren werden gedetecteerd in de cellijnmodellen, evenals hun gerelateerde primaire tumoren (75).
Nogmaals, de heterogene fenotypische toestanden konden niet worden gekoppeld aan detecteerbare genetische verschillen, en in verschillende gevallen is aangetoond dat FACS-gesorteerde cellen van een bepaalde toestand dynamisch opnieuw in evenwicht komen na kweek, wat een stabiel evenwicht recapituleert tussen de heterogene toestanden waargenomen in de oorspronkelijke cellijnen.
Bovendien belichten technologieën voor genoombrede profilering van verschillende attributen – naast de DNA-sequentie en de mutatievariatie ervan – invloedrijke elementen van de annotatie en organisatie van het kankercelgenoom die correleren met de prognose van de patiënt en, in toenemende mate, met karakteristieke capaciteiten (76 – 78). Epigenomische heterogeniteit wordt onthuld door steeds krachtigere technologieën voor het profileren van genoombrede DNA-methylatie (79, 80), histonmodificatie (81), toegankelijkheid van chromatine (82) en post-transcriptionele modificatie en vertaling van RNA (83, 84).
Een uitdaging met betrekking tot het hier beschouwde postulaat zal zijn om te bepalen welke epigenomische modificaties bij bepaalde soorten kanker (i) regulerende betekenis hebben en (ii) representatief zijn voor puur niet-mutationele herprogrammering, in tegenstelling tot mutatie-gedreven en dus genoom-verklaarbare instabiliteit.
Epigenetische regulatie van stromale celtypen die de micro-omgeving van de tumor bevolken
Over het algemeen wordt niet gedacht dat de hulpcellen in de micro-omgeving van de tumor die functioneel bijdragen aan de verwerving van karakteristieke vermogens lijden onder genetische instabiliteit en mutatieherprogrammering om hun tumorbevorderende activiteiten te versterken; er wordt eerder geconcludeerd dat deze cellen – met kanker geassocieerde fibroblasten, aangeboren immuuncellen en endotheelcellen en pericyten van het tumorvasculatuur – epigenetisch worden geherprogrammeerd bij hun rekrutering door oplosbare en fysieke factoren die de micro-omgeving van de vaste tumor definiëren (2, 85).
Er wordt verwacht dat de multi-omic profileringstechnologieën die momenteel op kankercellen worden toegepast, in toenemende mate zullen worden gebruikt om de bijkomende (stromale) cellen in tumoren te bestuderen om op te helderen hoe normale cellen worden beschadigd om de tumorontwikkeling en -progressie functioneel te ondersteunen. Een recente studie (86) suggereert bijvoorbeeld dat een dergelijke herprogrammering wijzigingen van het epigenoom met zich mee kan brengen, naast de inductieve uitwisseling van cytokinen, chemokinen en groeifactoren die de intracellulaire signaalnetwerken in al deze celtypen veranderen:
Toen muismodellen met longmetastasen werden behandeld met een combinatie van een DNA-methyltransferaseremmer (5-azacytidine) en een histonmodificatieremmer (een HDAC), bleken de infiltrerende myeloïde cellen te zijn overgegaan van een onrijpe (tumorbevorderende) voorloperstatus naar cellen die leken op volwassen interstitiële (tumor-antagoniserende) macrofagen, die, in tegenstelling tot hun tegenhangers in onbehandelde tumoren, niet in staat waren de typische vereiste capaciteiten te ondersteunen. voor efficiënte metastatische kolonisatie (86). Het is denkbaar dat multi-omische profilering en farmacologische verstoringen zullen dienen om de geherprogrammeerde epigenetische toestand in dergelijke myeloïde cellen op te helderen, evenals andere karakteristieke bijkomende celtypen die de micro-omgevingen van tumoren bevolken.
Samenvatting
Alles bij elkaar ondersteunen deze illustratieve snapshots de stelling dat epigenetische herprogrammering zonder mutatie geaccepteerd zal worden als een echte faciliterende eigenschap die dient om de verwerving van karakteristieke vermogens te vergemakkelijken (Fig. 3), verschillend van genomische DNA-instabiliteit en mutatie. In het bijzonder kan worden verwacht dat niet-mutationele epigenetische herprogrammering een integraal onderdeel zal blijken van het mogelijk maken van het voorlopige nieuwe onderscheidende vermogen van fenotypische plasticiteit dat hierboven is besproken, in het bijzonder als een drijvende kracht in de dynamische transcriptomische heterogeniteit die steeds beter wordt gedocumenteerd in kwaadaardige kankercel-TME's. De vooruitgang van single-cell multi-omic profileringstechnologieën zal licht werpen op de respectieve bijdragen en wisselwerking tussen mutatie-aangedreven en niet-mutatie-aangedreven epigenetische regulatie in de ontwikkeling van tumoren tijdens kwaadaardige progressie en metastase.
Polymorfe microbiomen
Er ontvouwt zich een verreikende grens in de biogeneeskunde door de diversiteit en variabiliteit te belichten van de overvloed aan micro-organismen, gezamenlijk de microbiota genoemd, die symbiotisch associëren met de barrièreweefsels van het lichaam die worden blootgesteld aan de externe omgeving - met name de epidermis en het interne slijmvlies van het maag-darmkanaal, evenals de longen, het borst- en urogenitale systeem.
Er wordt steeds meer erkend dat de ecosystemen die worden gecreëerd door de aanwezige bacteriën en schimmels – de microbiomen – diepgaande gevolgen hebben voor de gezondheid en ziekten (87), een besef dat wordt aangedreven door het vermogen om de populaties van microbiële soorten te screenen met behulp van de volgende generatie sequencing- en bio-informaticatechnologieën. Voor kanker wordt het bewijs steeds overtuigender dat polymorfe variabiliteit in de microbiomen tussen individuen in een populatie diepgaande effecten kan hebben op kankerfenotypes (88, 89).
Associatiestudies bij menselijke en experimentele manipulaties in muismodellen van kanker onthullen bepaalde micro-organismen, voornamelijk maar niet uitsluitend bacteriën, die beschermende of schadelijke effecten kunnen hebben op de ontwikkeling van kanker, de kwaadaardige progressie en de respons op therapie. Dit geldt ook voor de mondiale complexiteit en samenstelling van een weefselmicrobioom als geheel. Hoewel het darmmicrobioom de pionier was van deze nieuwe grens, hebben verschillende weefsels en organen microbiomen geassocieerd die onderscheidende kenmerken vertonen die verband houden met de populatiedynamiek en de diversiteit van microbiële soorten en ondersoorten.
Deze groeiende waardering voor het belang van polymorf variabele microbiomen in gezondheid en ziekte roept de vraag op: is het microbioom een afzonderlijke faciliterende eigenschap die zowel positief als negatief een grote invloed heeft op de verwerving van onderscheidende capaciteiten voor kanker? Ik beschouw deze mogelijkheid hieronder en illustreer het bewijs voor enkele van de prominente weefselmicrobiomen die betrokken zijn bij kankerkenmerken (Fig. 4), te beginnen met het meest prominente en ogenschijnlijk meest impactvolle microbioom, dat van het darmkanaal.
Figuur 4
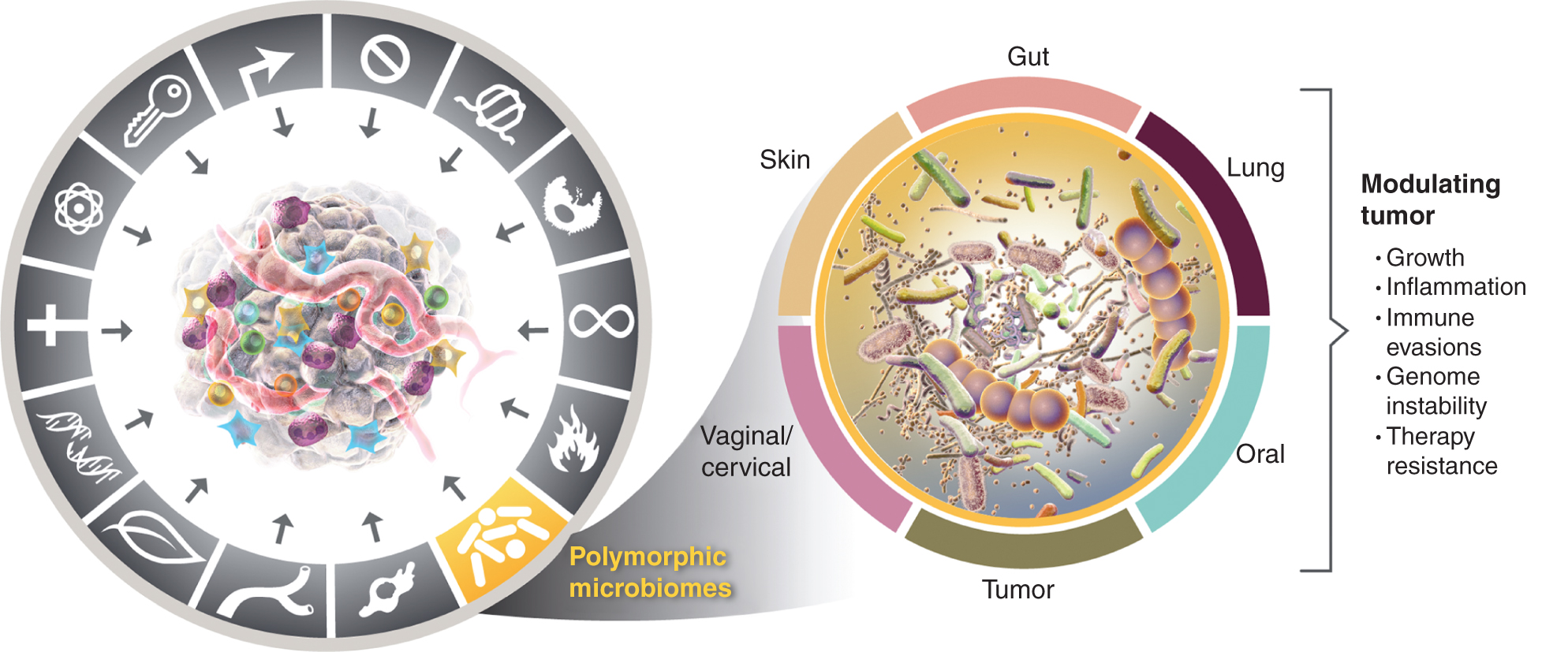
Terwijl de faciliterende eigenschappen van tumorbevorderende ontstekingen en genomische instabiliteit en mutatie elkaar overlappen, is er steeds meer reden om te concluderen dat polymorfe microbiomen die zich in het ene individu bevinden in vergelijking met het andere in de dikke darm, in andere slijmvliezen en bijbehorende organen, of in tumoren zelf, veel van de karakteristieke vermogens op verschillende manieren kunnen beïnvloeden – hetzij door inductie of remming – en daarom een instrumentele en quasi-onafhankelijke variabele kunnen zijn in de puzzel van hoe kanker zich ontwikkelt, voortschrijdt en groeit. therapie. Het is waar dat meerdere weefselmicrobiomen betrokken zijn bij het moduleren van tumorfenotypes. Naast het veel bestudeerde darmmicrobioom zijn ook andere karakteristieke weefselmicrobiomen en het tumormicrobioom betrokken bij het moduleren van de verwerving – zowel positief als negatief – van de karakteristieke vermogens die bij bepaalde tumortypen aanwezig zijn. De handelsmerken van de kankerafbeelding zijn overgenomen van Hanahan en Weinberg (2).
Meerdere modulerende effecten van het darmmicrobioom
Het is al lang bekend dat het darmmicrobioom van fundamenteel belang is voor de functie van de dikke darm (colon) bij het afbreken en importeren van voedingsstoffen in het lichaam als onderdeel van de metabolische homeostase, en dat verstoring van microbiële populaties – dysbiose – in de dikke darm een spectrum aan fysiologische ziekten kan veroorzaken (87). Daarbij hoort het vermoeden dat de gevoeligheid, ontwikkeling en pathogenese van darmkanker wordt beïnvloed door het darmmicrobioom. In de afgelopen jaren hebben overtuigende functionele onderzoeken met fecale transplantaties van darmtumordragende patiënten en muizen naar ontvangende muizen die vatbaar zijn voor de ontwikkeling van darmkanker een principe vastgesteld: er zijn zowel kankerbeschermende als tumorbevorderende microbiomen waarbij specifieke bacteriesoorten betrokken zijn die het optreden en de pathogenese van darmtumoren kunnen moduleren (90).
De mechanismen waarmee microbiota deze modulerende rollen vervullen worden nog steeds opgehelderd, maar twee algemene effecten worden steeds duidelijker vastgesteld voor tumorbevorderende microbiomen en, in sommige gevallen, voor specifieke tumorbevorderende bacteriesoorten. Het eerste effect is mutagenese van het colonepitheel als gevolg van de productie van bacteriële toxines en andere moleculen die óf direct DNA beschadigen óf de systemen verstoren die de genomische integriteit behouden of op een andere manier stress veroorzaken op cellen, waardoor indirect de betrouwbaarheid van DNA-replicatie en -reparatie wordt aangetast. Een typisch voorbeeld is E. coli, dat de PKS-locus draagt, waarvan is aangetoond dat het het menselijk genoom mutageniseert en betrokken is bij de overdracht van mutaties die de markering mogelijk maken (91).
Bovendien is gerapporteerd dat bacteriën zich binden aan het oppervlak van colonepitheelcellen en ligandmimetica produceren die epitheliale proliferatie stimuleren, wat bijdraagt aan het karakteristieke proliferatieve signaalvermogen in neoplastische cellen (88). Een ander mechanisme waardoor specifieke soorten bacteriën de ontwikkeling van tumoren bevorderen zijn butyraatproducerende bacteriën, waarvan de overvloed in patiënten met colorectale kanker toeneemt (92).
De productie van de metaboliet butyraat heeft complexe fysiologische effecten, waaronder de inductie van verouderde epitheel- en fibroblastcellen. Een muismodel van coloncarcinogenese gekoloniseerd met butyraatproducerende bacteriën ontwikkelde meer tumoren dan muizen zonder dergelijke bacteriën; Het verband tussen door butyraat geïnduceerde veroudering en verhoogde tumorigenese van de dikke darm is aangetoond door het gebruik van een senolytisch medicijn dat verouderingscellen doodt, waardoor de tumorgroei wordt belemmerd (92).
Bovendien heeft bacterieel geproduceerd butyraat pleiotrope en paradoxale effecten op gedifferentieerde cellen vergeleken met ongedifferentieerde (stam)cellen in het colonepitheel in omstandigheden waarbij de darmbarrière wordt verstoord (dysbiose) en de bacteriën invasief zijn, waardoor bijvoorbeeld de cellulaire energie en het metabolisme, histonmodificatie, celcyclusprogressie en (tumorbevorderende) aangeboren immuunontsteking worden beïnvloed die adaptieve immuunreacties onderdrukt (93).
Een brede werking van polymorfe microbiomen omvat inderdaad de modulatie van het adaptieve en aangeboren immuunsysteem via diverse routes, waaronder de productie van ‘immuunmodulerende’ factoren door bacteriën die schadesensoren op epitheliale of residente immuuncellen activeren, wat leidt tot de expressie van een divers repertoire van chemokinen en cytokines die de overvloed en eigenschappen kunnen bepalen van immuuncellen die het colonepitheel en het onderliggende stroma en de afvoerende lymfeklieren bevolken.
Bovendien kunnen bepaalde bacteriën zowel de beschermende biofilm als het slijm aan de binnenkant van het colonepitheel doorbreken en de nauwe verbindingen tussen epitheelcellen en cellen verstoren die gezamenlijk de integriteit van de fysieke barrière in stand houden die normaal gesproken het darmmicrobioom compartimenteert. Wanneer bacteriën het stroma binnendringen, kunnen ze zowel aangeboren als adaptieve immuunreacties veroorzaken door de uitscheiding van een repertoire van cytokinen en chemokinen op te wekken. Eén manifestatie kan de creatie zijn van tumorbevorderende of tumor-antagoniserende micro-omgevingen van het immuunsysteem, die bijgevolg bescherming bieden tegen tumorigenese en kwaadaardige progressie of deze vergemakkelijken.
Dienovereenkomstig kan de modulatie van de met elkaar verweven parameters van (i) de inductie van (aangeboren) tumorbevorderende ontstekingen en (ii) het ontsnappen aan (adaptieve) immuunvernietiging door karakteristieke microbiomen bij individuele patiënten niet alleen in verband worden gebracht met de prognose, maar ook met de respons op of resistentie tegen immuuntherapieën met immuuncontrolepuntremmers en andere therapeutische modaliteiten (een manifestatie kan de creatie zijn van tumorbevorderende of tumor-antagoniserende immuun-micro-omgevingen, die als gevolg daarvan optreden. ontwikkeling en kwaadaardige progressie.
Dienovereenkomstig kan de modulatie van de met elkaar verweven parameters van (i) de inductie van (aangeboren) tumorbevorderende ontstekingen en (ii) het ontsnappen aan (adaptieve) immuunvernietiging door karakteristieke microbiomen bij individuele patiënten niet alleen in verband worden gebracht met de prognose, maar ook met de respons op of resistentie tegen immuuntherapieën met immuuncheckpointremmers en andere therapeutische modaliteiten (een manifestatie kan de creatie zijn van tumorbevorderende of tumor-antagoniserende immuun-micro-omgevingen, die bijgevolg de tumor beschermen of vergemakkelijken). ontwikkeling en kwaadaardige progressie).
Dienovereenkomstig kan modulatie van de met elkaar verweven parameters van (i) inductie van (aangeboren) tumorbevorderende ontsteking en (ii) ontsnapping aan (adaptieve) immuunvernietiging door onderscheidende microbiomen bij individuele patiënten niet alleen geassocieerd zijn met de prognose, maar ook met respons of resistentie tegen immuuntherapieën met immuuncheckpointremmers en andere therapeutische modaliteiten (89, 94-96). Voorlopige proof-of-concept komt uit recente onderzoeken die de herstelde werkzaamheid van immunotherapie aantonen na transplantaties van fecale microbiota van therapierespondenten bij patiënten met melanoom dat was verergerd tijdens eerdere behandeling met immuuncontrolepuntblokkade (97, 98).
De moleculaire mechanismen waarmee afzonderlijke en variabele componenten van het darmmicrobioom de activiteit van het adaptieve immuunsysteem systemisch moduleren, blijven een hardnekkig mysterie, hetzij door het versterken van de antitumorale immuunresponsen die worden opgewekt door blokkade van het immuuncontrolepunt, of beter gezegd door het induceren van systemische of lokale (intratumorale) immuunsuppressie. Een recent onderzoek heeft licht geworpen: bepaalde stammen van Enterococcus (en andere bacteriën) brengen een peptidoglycaanhydrolyase tot expressie, SagA genaamd, dat mucopeptiden vrijmaakt uit de bacteriële wand, die vervolgens systemisch kunnen circuleren en de NOD2-patroonreceptor kunnen activeren, wat op zijn beurt de T-celreacties en de effectiviteit van checkpoint-immunotherapie verhoogt (99).
Andere immuunregulerende moleculen geproduceerd door specifieke bacteriële ondersoorten worden geïdentificeerd en functioneel beoordeeld, waaronder door bacteriën geproduceerd inosine, een snelheidsbeperkende metaboliet voor T-celactiviteit (100). Deze en andere voorbeelden beginnen de moleculaire mechanismen af te bakenen waarmee polymorfe microbiomen indirect en systemisch de immunobiologie van tumoren moduleren, boven en buiten de immuunresponsen die volgen op directe fysieke interacties van bacteriën met het immuunsysteem (101, 102).
Afgezien van de causale verbanden met darmkanker en melanoom, is het aangetoonde vermogen van het darmmicrobioom om de expressie van immuunmodulerende chemokinen en cytokinen die de systemische circulatie binnendringen op te wekken blijkbaar ook in staat de pathogenese van kanker en de reactie op therapieën in andere organen van het lichaam te beïnvloeden (94, 95).
Een verhelderend voorbeeld betreft de ontwikkeling van cholangiocarcinomen in de lever: darmdysbiose maakt toegang en transport van bacteriën en bacteriële producten via de poortader naar de lever mogelijk, waar TLR4 tot expressie gebracht op hepatocyten wordt geactiveerd om expressie van het chemokine CXCL1 te induceren, dat CXCR2 tot expressie brengende granulocytische myeloïde cellen (gMDSC) recruteert die dienen om natuurlijke killercellen te onderdrukken om immuunvernietiging te omzeilen (103) en waarschijnlijk andere onderscheidende vermogens over te brengen (85). Als zodanig is het darmmicrobioom duidelijk betrokken als een faciliterende eigenschap die op alternatieve wijze meerdere vormen van kanker kan vergemakkelijken of beschermen.
Voorbij de darmen: verschillende microbiomen impliceren in andere barrièreweefsels
Bijna alle weefsels en organen die direct of indirect worden blootgesteld aan de externe omgeving zijn ook opslagplaatsen van commensale micro-organismen (104). In tegenstelling tot de darmen, waar de symbiotische rol van het microbioom in de stofwisseling goed wordt erkend, zijn de normale en pathogene rollen van de aanwezige microbiota op deze diverse locaties nog steeds in opkomst.
Er zijn duidelijke orgaan-/weefselspecifieke verschillen in de samenstelling van de geassocieerde microbiomen bij homeostase, veroudering en kanker, met zowel overlappende als onderscheidende soorten en frequenties ten opzichte van die van de dikke darm (104, 105). Bovendien leveren associatiestudies steeds meer bewijs op dat lokale tumorantagoniserende/beschermende versus tumorbevorderende weefselmicrobiomen, vergelijkbaar met het darmmicrobioom, de gevoeligheid en pathogenese voor menselijke kankers die ontstaan in de bijbehorende organen kunnen moduleren (106 – 109).
Invloed van de intratumorale microbiota?
Ten slotte hebben pathologen al lang erkend dat bacteriën kunnen worden gedetecteerd in solide tumoren, een observatie die nu is bevestigd door geavanceerde profileringstechnologieën. In een onderzoek onder 1.526 tumoren verspreid over zeven menselijke kankertypes (bot-, hersen-, borst-, long-, melanoom-, eierstok- en pancreas-) werd elk type bijvoorbeeld gekenmerkt door een onderscheidend microbioom, dat zich grotendeels in kankercellen en immuuncellen bevond. Binnen elk tumortype zijn variaties in het tumormicrobioom aangetoond en geconcludeerd dat deze verband houden met klinisch-pathologische kenmerken (110).
Microbiota zijn op vergelijkbare wijze gedetecteerd in de novo genetisch gemanipuleerde muismodellen van long- en pancreaskanker, en er kan worden aangetoond dat hun afwezigheid bij kiemvrije muizen en/of hun opheffing met antibiotica de tumorgenese schaadt, waardoor het tumormicrobioom functioneel wordt geïmpliceerd als een voorloper van tumorbevorderende ontstekingen en kwaadaardige progressie (111, 112).
Associatiestudies bij ductaal adenocarcinoom van de menselijke pancreas en functionele testen via fecale transplantatie in tumordragende muizen hebben aangetoond dat variaties in het tumormicrobioom – en het bijbehorende darmmicrobioom – de fenotypes en overleving van het immuunsysteem moduleren (113). Een belangrijke uitdaging voor de toekomst zal zijn om deze implicaties uit te breiden naar andere tumortypen en om de potentieel scheidbare bijdragen van constitutie en variatie in het tumormicrobioom te ontwarren van die van het darmmicrobioom (en het lokale weefsel van oorsprong), misschien door specifieke microbiële soorten te identificeren die op de ene of andere locatie functioneel invloed hebben.
Samenvatting
Intrigerende vragen voor de toekomst zijn onder meer de vraag of microbiota die zich in verschillende weefsels bevinden of beginnende neoplasmata bevolken het vermogen hebben om bij te dragen aan of de verwerving van andere onderscheidende capaciteiten te verstoren dan immunomodulatie en genomische mutatie, waardoor de ontwikkeling en progressie van tumoren worden beïnvloed. Er zijn aanwijzingen dat bepaalde bacteriesoorten direct het kenmerk van proliferatieve signalering kunnen stimuleren, bijvoorbeeld in het colonepitheel (88), en de onderdrukking van de groei kunnen moduleren door de tumorsuppressoractiviteit in verschillende compartimenten van de darm te veranderen (114), terwijl directe effecten op andere kenmerkende vermogens, zoals het vermijden van celdood, het teweegbrengen van angiogenese en het stimuleren van invasie en metastase, onduidelijk blijven, evenals de generaliseerbaarheid van deze waarnemingen naar meerdere vormen van menselijke kanker.
Hoe dan ook, er zijn steeds overtuigender argumenten dat polymorfe variatie in de microbiomen van de darmen en andere organen een onderscheidend activerend kenmerk vertegenwoordigt voor het verwerven van onderscheidende vaardigheden (Fig. 4), zelfs als het overlapt met en een aanvulling vormt op die van genoominstabiliteit en -mutatie, en tumorbevorderende ontstekingen.
Senescente cellen
Cellulaire veroudering is een typisch onomkeerbare vorm van proliferatieve arrestatie die waarschijnlijk is geëvolueerd als een beschermend mechanisme om weefselhomeostase te handhaven, ogenschijnlijk als een complementair mechanisme voor geprogrammeerde celdood dat dient om zieke, disfunctionele of anderszins onnodige cellen te inactiveren en, op termijn, te verwijderen. Naast het stopzetten van de celdelingscyclus veroorzaakt het senescentieprogramma veranderingen in de celmorfologie en het metabolisme en, het meest diepgaand, de activering van een senescentie-geassocieerd secretoir fenotype (SASP), wat de afgifte van een overvloed aan bioactieve eiwitten met zich meebrengt, waaronder chemokinen.
Cytokinen en proteasen, waarvan de identiteit afhangt van het cel- en weefseltype waaruit een verouderde cel voortkomt (115-117). Veroudering kan in cellen worden geïnduceerd door een verscheidenheid aan omstandigheden, waaronder stress in de micro-omgeving, zoals uithongering van voedingsstoffen en DNA-schade, evenals schade aan organellen en cellulaire infrastructuur en onevenwichtigheden in cellulaire signaalnetwerken (115, 117), die allemaal hebben plaatsgevonden in de context van de waargenomen toename in de frequentie van senescente cellen in verschillende organen tijdens het ouder worden (118, 119).
Cellulaire veroudering wordt lange tijd beschouwd als een beschermend mechanisme tegen neoplasie, waardoor kankercellen veroudering ondergaan (120). De meeste van de hierboven genoemde initiatiefnemers van het senescentieprogramma worden in verband gebracht met maligniteit, vooral DNA-schade als gevolg van afwijkende hyperproliferatie, zogenaamde oncogen-geïnduceerde senescentie als gevolg van hypergeactiveerde signalering en therapie-geïnduceerde senescentie als gevolg van cellulaire en genomische schade veroorzaakt door chemotherapie en radiotherapie.
Er zijn inderdaad gevestigde voorbeelden van de beschermende voordelen van veroudering bij het beperken van kwaadaardige progressie (118, 119). Integendeel, echter, een groeiend aantal bewijzen toont precies het tegenovergestelde aan: in bepaalde contexten stimuleren verouderde cellen op verschillende manieren de ontwikkeling van tumoren en de progressie van kwaadaardige ziekten (119, 121).
In een verhelderende casestudy werden verouderde cellen bij ouder wordende muizen farmacologisch geablateerd, waarbij met name verouderde cellen werden uitgeput die kenmerkend de celcyclusremmer p16 – INK4a tot expressie brengen: naast het uitstellen van verschillende leeftijdsgerelateerde symptomen resulteerde dit in uitputting van verouderde cellen bij ouder wordende muizen met verminderde incidentie van spontane tumorigenese en kanker-geassocieerde sterfte (122).
Aangenomen wordt dat het belangrijkste mechanisme waarmee senescente cellen tumorfenotypes bevorderen de SASP is, waarvan is aangetoond dat het in staat is signaalmoleculen (en proteasen die activeren en/of deactiveren) op een paracriene manier te mediëren om typische vermogens te mediëren. In verschillende experimentele systemen is dus aangetoond dat verouderde kankercellen op verschillende manieren bijdragen aan proliferatieve signalering, apoptose vermijden, angiogenese induceren, invasie en metastase stimuleren en tumorimmuniteit onderdrukken (116, 118, 120, 121).
Nog een ander facet van de effecten van senescente kankercellen op kankerfenotypes omvat voorbijgaande, omkeerbare senescente celtoestanden, waarbij senescente kankercellen kunnen ontsnappen aan hun SASP-tot expressie brengende, niet-proliferatieve toestand en de celproliferatie en de manifestatie van de daarmee samenhangende capaciteiten van een volledig levensvatbare oncogencel kunnen hervatten (44).
Een dergelijke voorbijgaande veroudering wordt het best gedocumenteerd in gevallen van therapieresistentie (44), die een vorm van rust vertegenwoordigt die therapeutische targeting van prolifererende kankercellen omzeilt, maar breder effectief zou kunnen blijken in andere stadia van tumorontwikkeling, kwaadaardige progressie en metastase.
Bovendien zijn de kenmerkende eigenschappen van senescente cellen niet beperkt tot senescente kankercellen. Er is aangetoond dat kankergeassocieerde fibroblasten (CAF) verouderen in tumoren, wat aanleiding geeft tot senescente CAF's waarvan is aangetoond dat ze tumorbevorderend zijn door karakteristieke vermogens te verlenen aan kankercellen in de TME (115, 116, 121).
Bovendien zijn senescente fibroblasten in normale weefsels, gedeeltelijk gevormd door natuurlijke veroudering of omgevingsinvloeden, op vergelijkbare wijze betrokken bij het hermodelleren van de micro-omgevingen van weefsel via hun SASP om paracriene ondersteuning te bieden voor lokale invasie (zogenaamde “veldeffecten”) en metastasen op afstand (116) van neoplasmata die zich in de buurt ontwikkelen.
Bovendien is aangetoond dat senescente fibroblasten in de verouderende huid via hun SASP aangeboren immuuncellen rekruteren die zowel immunosuppressief zijn voor adaptieve antitumorale immuunresponsen verankerd door CD8 T-cellen als de groei van huidtumoren stimuleren (123), waarbij dit laatste effect mogelijk de paracriene bijdragen weerspiegelt van dergelijke aangeboren immuuncellen (myeloïde cellen, neutrofielen en macrofagen) aan andere karakteristieke capaciteiten.
Hoewel minder goed ingeburgerd, lijkt het waarschijnlijk dat andere overvloedige stromacellen die specifieke micro-omgevingen van tumoren bevolken, senescentie zullen ondergaan, waardoor de kankerkenmerken en de daaruit voortvloeiende tumorfenotypes zullen worden gemoduleerd. Door therapie geïnduceerde verouderde tumor-endotheelcellen kunnen bijvoorbeeld de proliferatie, invasie en metastase in borstkankermodellen versterken (124, 125).
Dergelijk bewijs rechtvaardigt zeker onderzoek bij andere tumortypen om de algemene veroudering van fibroblasten, endotheelcellen en andere stromale cellen te evalueren als drijvende kracht achter de ontwikkeling van tumoren. Ook momenteel onduidelijk zijn de regulerende mechanismen en functionele determinanten waardoor een bepaald ouder wordend celtype in een bepaalde TME een tumorbevorderende versus een tumor-antagoniserende SASP uitlokt, die blijkbaar alternatief kan worden geïnduceerd in hetzelfde verouderde celtype, misschien door verschillende initiatiefnemers wanneer ze worden ondergedompeld in karakteristieke fysiologische en neoplastische micro-omgevingen.
Samenvatting
Het concept dat tumoren bestaan uit genetisch getransformeerde kankercellen die interageren met en profiteren van gerecruteerde en epigenetisch/fenotypisch gecorrumpeerde bijkomende (stromale) cellen is cruciaal gebleken voor de pathogenese van kanker. De overwegingen die hierboven zijn besproken en die zijn beschreven in de hier (en elders) geciteerde recensies en rapporten, beargumenteren overtuigend dat verouderde cellen (ongeacht hun cellulaire oorsprong) moeten worden overwogen voor opname in de lijst van functioneel significante cellen in de micro-omgeving van de tumor (Fig. 5). Daarom moeten verouderde cellen worden overwogen bij het zoeken naar diepgaande kennis van kankermechanismen. Bovendien motiveert de erkenning van hun belang het secundaire doel van het therapeutisch richten op tumorbevorderende verouderde cellen van alle constituties, zij het door farmacologische of immunologische ablatie of door het herprogrammeren van de SASP in tumor-antagoniserende varianten (115, 121, 126).
Figuur 5

Heterogene kankercelsubtypen en stromale celtypen en subtypen zijn functioneel geïntegreerd in de manifestaties van tumoren als illegale organen. Toenemend bewijs suggereert dat verouderde celderivaten van veel van deze cellulaire componenten van de TME en hun variabele SASP's betrokken zijn bij de modulatie van kenmerkende capaciteiten en resulterende tumorfenotypes. De handelsmerken van de kankerafbeelding zijn overgenomen van Hanahan en Weinberg (2).
Slotopmerkingen
Hoewel bewezen is dat de acht kenmerken van kanker en hun twee ondersteunende kenmerken blijvende heuristische waarde hebben bij de conceptualisering van kanker, suggereren de hierboven gepresenteerde overwegingen dat er nieuwe facetten kunnen zijn die enigszins algemeen zijn en daarom van belang zijn voor een vollediger begrip van de complexiteit, mechanismen en manifestaties van de ziekte. Door de metriek van waarneembare, zo niet volledige, onafhankelijkheid van de tien kernattributen toe te passen, kan worden gesteld dat deze vier parameters – na verdere validatie en generalisatie buiten de gepresenteerde casestudies – heel goed kunnen worden geïntegreerd in de kenmerken van het kankerschema (Fig. 6).
Daarom zou cellulaire plasticiteit kunnen worden toegevoegd aan de lijst met prominente mogelijkheden. Hoewel de achtste kern en dit nouveau-vermogen elk conceptueel te onderscheiden zijn door hun definitie als kenmerken, zijn aspecten van hun regulatie bij sommige en misschien wel veel vormen van kanker op zijn minst gedeeltelijk met elkaar verbonden. Bij sommige tumortypen worden bijvoorbeeld meerdere kenmerken gecoördineerd gemoduleerd door canonieke oncogene factoren
- (I) KRAS ( https://cancer.sanger.ac.uk/cosmic/census-page/KRAS ),
- (II) MYC ( https://cancer.sanger.ac.uk/cosmic/census-page/MYC ),
- (III) NOTCH ( https://cancer.sanger.ac.uk/cosmic/census-page/NOTCH1 ; Ref. 127) und
- (IV) TP53 ( https://cancer.sanger.ac.uk/cosmic/census-page/TP53 )
Figuur 6
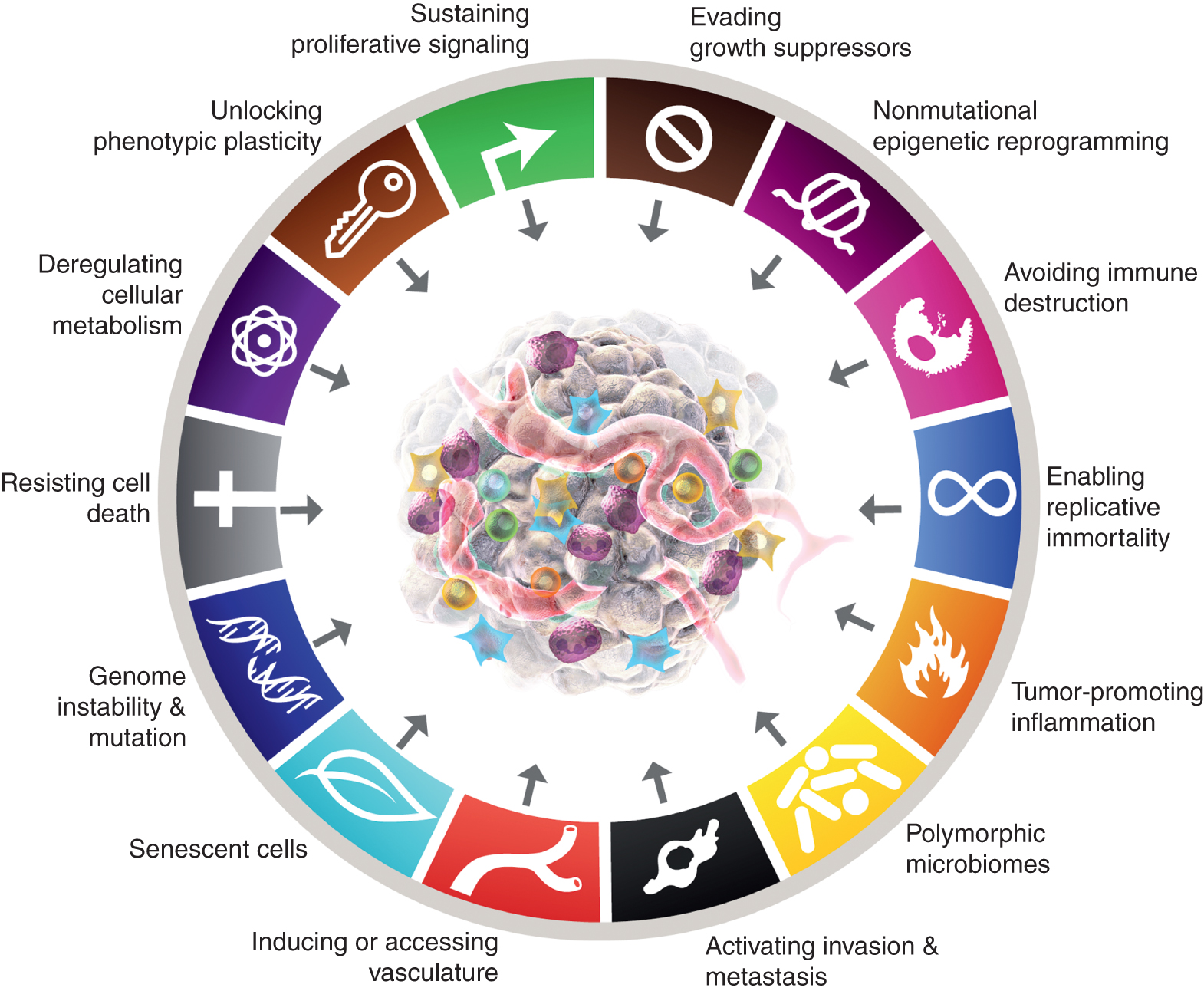
De canonieke en verwachte nieuwe toevoegingen aan de “Hallmarks of Cancer” worden getoond. Dit artikel brengt de mogelijkheid naar voren, met als doel het stimuleren van debat, discussie en experimentele uitwerking, dat sommige of alle van de vier nieuwe parameters erkend zullen worden als generiek voor meerdere vormen van kanker bij de mens en daarom geschikt zijn voor integratie in de kernconceptualisatie van de kenmerken van kanker. De handelsmerken van de kankerafbeelding zijn overgenomen van Hanahan en Weinberg (2).
Naast het toevoegen van cellulaire plasticiteit aan het rooster, kunnen niet-mutationele epigenetische herprogrammering en polymorfe variaties worden geïntegreerd in orgaan-/weefselmicrobiomen als mechanistische determinanten – mogelijk makende eigenschappen – waardoor onderscheidende vermogens worden verworven, samen met tumorbevorderende ontstekingen (op zichzelf gedeeltelijk verbonden met het microbioom), voorbij de mutaties en andere aberraties die de hierboven genoemde oncogene factoren manifesteren.
Ten slotte kunnen senescente cellen van verschillende oorsprong – waaronder kankercellen en verschillende stromale cellen – die functioneel bijdragen aan de ontwikkeling en kwaadaardige progressie van kanker, zij het op duidelijk verschillende manieren dan die van hun niet-senescente broeders, worden opgenomen als generieke componenten van de TME. Samenvattend is het de bedoeling dat de inzet van deze voorlopige “experimentele ballonnen” het debat, de discussie en verder experimenteel onderzoek in de kankeronderzoeksgemeenschap over de bepalende conceptuele parameters van de kankerbiologie, genetica en pathogenese zal stimuleren.
Referenties
- Hanahan D , Weinberg RA . The hallmarks of cancer. Cell 2000;100:57–70.
- Hanahan D , Weinberg RA . Hallmarks of cancer: the next generation. Cell 2011;144:646–74.
- Yuan S , Norgard RJ , Stanger BZ . Cellular plasticity in cancer. Cancer Discov 2019;9:837–51.
- Barker N , Ridgway RA , van Es JH , van de Wetering M , Begthel H , van den Born M et al . Crypt stem cells as the cells-of-origin of intestinal cancer. Nature 2009;457:608–11.
- Perekatt AO , Shah PP , Cheung S , Jariwala N , Wu A , Gandhi V et al . SMAD4 suppresses WNT-driven dedifferentiation and oncogenesis in the differentiated gut epithelium. Cancer Res 2018;78:4878–90.
- Shih IM , Wang TL , Traverso G , Romans K , Hamilton SR , Ben-Sasson S et al . Top-down morphogenesis of colorectal tumors. Proc Natl Acad Sci U S A 2001;98:2640–5.
- Ordóñez-Morán P , Dafflon C , Imajo M , Nishida E , Huelsken J . HOXA5 counteracts stem cell traits by inhibiting Wnt signaling in colorectal cancer. Cancer Cell 2015;28:815–29.
- Tan SH , Barker N . Stemming colorectal cancer growth and metastasis: HOXA5 forces cancer stem cells to differentiate. Cancer Cell 2015;28:683–5.
- Köhler C , Nittner D , Rambow F , Radaelli E , Stanchi F , Vandamme N et al . Mouse cutaneous melanoma induced by mutant BRaf arises from expansion and dedifferentiation of mature pigmented melanocytes. Cell Stem Cell 2017;21:679–93.
- Shah M , Bhoumik A , Goel V , Dewing A , Breitwieser W , Kluger H et al . A role for ATF2 in regulating MITF and melanoma development. PLoS Genet 2010;6:e1001258.
- Claps G , Cheli Y , Zhang T , Scortegagna M , Lau E , Kim H et al . A transcriptionally inactive ATF2 variant drives melanomagenesis. Cell Rep 2016;15:1884–92.
- Saghafinia S , Homicsko K , Di Domenico A , Wullschleger S , Perren A , Marinoni I et al . Cancer cells retrace a stepwise differentiation program during malignant progression. Cancer Discov 2021;11:2638–57.
- Yu X-X , Qiu W-L , Yang L , Zhang Y , He M-Y , Li L-C et al . Defining multistep cell fate decision pathways during pancreatic development at single-cell resolution. EMBO J 2019;38:e100164.
- de Thé H . Differentiation therapy revisited. Nat Rev Cancer 2018;18:117–27.
- He LZ , Merghoub T , Pandolfi PP . In vivo analysis of the molecular pathogenesis of acute promyelocytic leukemia in the mouse and its therapeutic implications. Oncogene 1999;18:5278–92.
- Warrell RP , de Thé H , Wang ZY , Degos L . Acute promyelocytic leukemia. N Engl J Med 1993;329:177–89.
- Bots M , Verbrugge I , Martin BP , Salmon JM , Ghisi M , Baker A et al . Differentiation therapy for the treatment of t(8;21) acute myeloid leukemia using histone deacetylase inhibitors. Blood 2014;123:1341–52.
- Ferrara FF , Fazi F , Bianchini A , Padula F , Gelmetti V , Minucci S et al . Histone deacetylase-targeted treatment restores retinoic acid signaling and differentiation in acute myeloid leukemia. Cancer Res 2001;61:2–7.
- Kaufman CK , Mosimann C , Fan ZP , Yang S , Thomas AJ , Ablain J et al . A zebrafish melanoma model reveals emergence of neural crest identity during melanoma initiation. Science 2016;351:aad2197.
- Morris JP , Yashinskie JJ , Koche R , Chandwani R , Tian S , Chen C-C et al . α-Ketoglutarate links p53 to cell fate during tumour suppression. Nature 2019;573:595–9.
- Saha SK , Parachoniak CA , Ghanta KS , Fitamant J , Ross KN , Najem MS et al . Mutant IDH inhibits HNF-4α to block hepatocyte differentiation and promote biliary cancer. Nature 2014;513:110–4.
- Dang L , Su S-SM . Isocitrate dehydrogenase mutation and (R)-2-hydroxyglutarate: from basic discovery to therapeutics development. Annu Rev Biochem 2017;86:305–31.
- Waitkus MS , Diplas BH , Yan H . Biological role and therapeutic potential of IDH mutations in cancer. Cancer Cell 2018;34:186–95.
- Phan TG , Croucher PI . The dormant cancer cell life cycle. Nat Rev Cancer 2020;20:398–411.
- Jiang M , Azevedo-Pouly AC , Deering TG , Hoang CQ , DiRenzo D , Hess DA et al . MIST1 and PTF1 collaborate in feed-forward regulatory loops that maintain the pancreatic acinar phenotype in adult mice. Mol Cell Biol 2016;36:2945–55.
- Krah NM , Narayanan SM , Yugawa DE , Straley JA , Wright CVE , MacDonald RJ et al . Prevention and reversion of pancreatic tumorigenesis through a differentiation-based mechanism. Dev Cell 2019;50:744–54.
- Krah NM , De La O J-P , Swift GH , Hoang CQ , Willet SG , Chen Pan F et al . The acinar differentiation determinant PTF1A inhibits initiation of pancreatic ductal adenocarcinoma. eLife 2015;4:e07125.
- Shi G , DiRenzo D , Qu C , Barney D , Miley D , Konieczny SF . Maintenance of acinar cell organization is critical to preventing Kras-induced acinar-ductal metaplasia. Oncogene 2013;32:1950–8.
- Kopp JL , von Figura G , Mayes E , Liu F-F , Dubois CL , Morris JP et al . Identification of Sox9-dependent acinar-to-ductal reprogramming as the principal mechanism for initiation of pancreatic ductal adenocarcinoma. Cancer Cell 2012;22:737–50.
- Julian LM , McDonald AC , Stanford WL . Direct reprogramming with SOX factors: masters of cell fate. Curr Opin Genet Dev 2017;46:24–36.
- Grimm D , Bauer J , Wise P , Krüger M , Simonsen U , Wehland M et al . The role of SOX family members in solid tumours and metastasis. Semin Cancer Biol 2020;67:122–53.
- Mu P , Zhang Z , Benelli M , Karthaus WR , Hoover E , Chen C-C et al . SOX2 promotes lineage plasticity and antiandrogen resistance in TP53- and RB1-deficient prostate cancer. Science 2017;355:84–8.
- Von Hoff DD , LoRusso PM , Rudin CM , Reddy JC , Yauch RL , Tibes R et al . Inhibition of the hedgehog pathway in advanced basal-cell carcinoma. N Engl J Med 2009;361:1164–72.
- Biehs B , Dijkgraaf GJP , Piskol R , Alicke B , Boumahdi S , Peale F et al . A cell identity switch allows residual BCC to survive Hedgehog pathway inhibition. Nature 2018;562:429–33.
- Boumahdi S , de Sauvage FJ . The great escape: tumour cell plasticity in resistance to targeted therapy. Nat Rev Drug Discov 2020;19:39–56.
- Groves SM , Ireland A , Liu Q , Simmons AJ , Lau K , Iams WT et al . Cancer Hallmarks Define a Continuum of Plastic Cell States between Small Cell Lung Cancer Archetypes [Internet]. Systems Biology; 2021 Jan. Available from: http://biorxiv.org/lookup/doi/10.1101/2021.01.22.427865.
- LaFave LM , Kartha VK , Ma S , Meli K , Del Priore I , Lareau C et al . Epigenomic state transitions characterize tumor progression in mouse lung adenocarcinoma. Cancer Cell 2020;38:212–28.
- Marjanovic ND , Hofree M , Chan JE , Canner D , Wu K , Trakala M et al . Emergence of a high-plasticity cell state during lung cancer evolution. Cancer Cell 2020;38:229–46.
- Drapkin BJ , Minna JD . Studying lineage plasticity one cell at a time. Cancer Cell 2020;38:150–2.
- Inoue Y , Nikolic A , Farnsworth D , Liu A , Ladanyi M , Somwar R et al . Extracellular signal-regulated kinase mediates chromatin rewiring and lineage transformation in lung cancer [Internet]. Cancer Biology; 2020 Nov. Available from: http://biorxiv.org/lookup/doi/10.1101/2020.11.12.368522.
- Dravis C , Chung C-Y , Lytle NK , Herrera-Valdez J , Luna G , Trejo CL et al . Epigenetic and transcriptomic profiling of mammary gland development and tumor models disclose regulators of cell state plasticity. Cancer Cell 2018;34:466–82.
- Malta TM , Sokolov A , Gentles AJ , Burzykowski T , Poisson L , Weinstein JN et al . Machine learning identifies stemness features associated with oncogenic dedifferentiation. Cell 2018;173:338–54.
- Miao Z-F , Lewis MA , Cho CJ , Adkins-Threats M , Park D , Brown JW et al . A dedicated evolutionarily conserved molecular network licenses differentiated cells to return to the cell cycle. Dev Cell 2020;55:178–94.
- De Blander H , Morel A-P , Senaratne AP , Ouzounova M , Puisieux A . Cellular plasticity: a route to senescence exit and tumorigenesis. Cancers 2021;13:4561.
- Merrell AJ , Stanger BZ . Adult cell plasticity in vivo: de-differentiation and transdifferentiation are back in style. Nat Rev Mol Cell Biol 2016;17:413–25.
- Baylin SB , Jones PA . Epigenetic determinants of cancer. Cold Spring Harb Perspect Biol 2016;8:a019505.
- Flavahan WA , Gaskell E , Bernstein BE . Epigenetic plasticity and the hallmarks of cancer. Science 2017;357:eaal2380.
- Jones PA , Issa J-PJ , Baylin S . Targeting the cancer epigenome for therapy. Nat Rev Genet 2016;17:630–41.
- Huang S . Tumor progression: Chance and necessity in Darwinian and Lamarckian somatic (mutationless) evolution. Prog Biophys Mol Biol 2012;110:69–86.
- Darwiche N . Epigenetic mechanisms and the hallmarks of cancer: an intimate affair. Am J Cancer Res 2020;10:1954–78.
- Feng Y , Liu X , Pauklin S . 3D chromatin architecture and epigenetic regulation in cancer stem cells. Protein Cell 2021;12:440–54.
- Nam AS , Chaligne R , Landau DA . Integrating genetic and non-genetic determinants of cancer evolution by single-cell multi-omics. Nat Rev Genet 2021;22:3–18.
- Bitman-Lotan E , Orian A . Nuclear organization and regulation of the differentiated state. Cell Mol Life Sci CMLS 2021;78:3141–58.
- Goldberg AD , Allis CD , Bernstein E . Epigenetics: a landscape takes shape. Cell 2007;128:635–8.
- Zeng Y , Chen T . DNA methylation reprogramming during mammalian development. Genes 2019;10:257.
- Hegde AN , Smith SG . Recent developments in transcriptional and translational regulation underlying long-term synaptic plasticity and memory. Learn Mem 2019;26:307–17.
- Kim S , Kaang B-K . Epigenetic regulation and chromatin remodeling in learning and memory. Exp Mol Med 2017;49:e281.
- Thienpont B , Van Dyck L , Lambrechts D . Tumors smother their epigenome. Mol Cell Oncol 2016;3:e1240549.
- Gameiro PA , Struhl K . Nutrient deprivation elicits a transcriptional and translational inflammatory response coupled to decreased protein synthesis. Cell Rep 2018;24:1415–24.
- Lin GL , Monje M . Understanding the deadly silence of posterior fossa A ependymoma. Mol Cell 2020;78:999–1001.
- Michealraj KA , Kumar SA , Kim LJY , Cavalli FMG , Przelicki D , Wojcik JB et al . Metabolic regulation of the epigenome drives lethal infantile ependymoma. Cell 2020;181:1329–45.
- Bakir B , Chiarella AM , Pitarresi JR , Rustgi AK . EMT, MET, plasticity, and tumor metastasis. Trends Cell Biol 2020;30:764–76.
- Gupta PB , Pastushenko I , Skibinski A , Blanpain C , Kuperwasser C . Phenotypic plasticity: driver of cancer initiation, progression, and therapy resistance. Cell Stem Cell 2019;24:65–78.
- Lambert AW , Weinberg RA . Linking EMT programmes to normal and neoplastic epithelial stem cells. Nat Rev Cancer 2021;21:325–38.
- Lindner P , Paul S , Eckstein M , Hampel C , Muenzner JK , Erlenbach-Wuensch K et al . EMT transcription factor ZEB1 alters the epigenetic landscape of colorectal cancer cells. Cell Death Dis 2020;11:147.
- Javaid S , Zhang J , Anderssen E , Black JC , Wittner BS , Tajima K et al . Dynamic chromatin modification sustains epithelial-mesenchymal transition following inducible expression of Snail-1. Cell Rep 2013;5:1679–89.
- Serrano-Gomez SJ , Maziveyi M , Alahari SK . Regulation of epithelial-mesenchymal transition through epigenetic and post-translational modifications. Mol Cancer 2016;15:18.
- Skrypek N , Goossens S , De Smedt E , Vandamme N , Berx G . Epithelial-to-mesenchymal transition: epigenetic reprogramming driving cellular plasticity. Trends Genet TIG 2017;33:943–59.
- Li L , Hanahan D . Hijacking the neuronal NMDAR signaling circuit to promote tumor growth and invasion. Cell 2013;153:86–100.
- Li L , Zeng Q , Bhutkar A , Galván JA , Karamitopoulou E , Noordermeer D et al . GKAP acts as a genetic modulator of NMDAR signaling to govern invasive tumor growth. Cancer Cell 2018;33:736–51.
- Mohammadi H , Sahai E . Mechanisms and impact of altered tumour mechanics. Nat Cell Biol 2018;20:766–74.
- Odenthal J , Takes R , Friedl P . Plasticity of tumor cell invasion: governance by growth factors and cytokines. Carcinogenesis 2016;37:1117–28.
- Torres CM , Biran A , Burney MJ , Patel H , Henser-Brownhill T , Cohen A-HS et al . The linker histone H1.0 generates epigenetic and functional intratumor heterogeneity. Science 2016;353:aaf1644.
- Puram SV , Tirosh I , Parikh AS , Patel AP , Yizhak K , Gillespie S et al . Single-cell transcriptomic analysis of primary and metastatic tumor ecosystems in head and neck cancer. Cell 2017;171:1611–24.
- Kinker GS , Greenwald AC , Tal R , Orlova Z , Cuoco MS , McFarland JM et al . Pan-cancer single-cell RNA-seq identifies recurring programs of cellular heterogeneity. Nat Genet 2020;52:1208–18.
- Murtha M , Esteller M . Extraordinary cancer epigenomics: thinking outside the classical coding and promoter box. Trends Cancer 2016;2:572–84.
- Nebbioso A , Tambaro FP , Dell’Aversana C , Altucci L . Cancer epigenetics: moving forward. PLoS Genet 2018;14:e1007362.
- Tavernari D , Battistello E , Dheilly E , Petruzzella AS , Mina M , Sordet-Dessimoz J et al . Non-genetic evolution drives lung adenocarcinoma spatial heterogeneity and progression. Cancer Discov 2021;11:1490–507.
- Heyn H , Vidal E , Ferreira HJ , Vizoso M , Sayols S , Gomez A et al . Epigenomic analysis detects aberrant super-enhancer DNA methylation in human cancer. Genome Biol 2016;17:11.
- Saghafinia S , Mina M , Riggi N , Hanahan D , Ciriello G . Pan-cancer landscape of aberrant DNA methylation across human tumors. Cell Rep 2018;25:1066–80.
- Audia JE , Campbell RM . Histone modifications and cancer. Cold Spring Harb Perspect Biol 2016;8:a019521.
- Corces MR , Granja JM , Shams S , Louie BH , Seoane JA , Zhou W et al . The chromatin accessibility landscape of primary human cancers. Science 2018;362:eaav1898.
- Esteve-Puig R , Bueno-Costa A , Esteller M . Writers, readers and erasers of RNA modifications in cancer. Cancer Lett 2020;474:127–37.
- Janin M , Coll-SanMartin L , Esteller M . Disruption of the RNA modifications that target the ribosome translation machinery in human cancer. Mol Cancer 2020;19:70.
- Hanahan D , Coussens LM . Accessories to the crime: functions of cells recruited to the tumor microenvironment. Cancer Cell 2012;21:309–22.
- Lu Z , Zou J , Li S , Topper MJ , Tao Y , Zhang H et al . Epigenetic therapy inhibits metastases by disrupting premetastatic niches. Nature 2020;579:284–90.
- Thomas S , Izard J , Walsh E , Batich K , Chongsathidkiet P , Clarke G et al . The host microbiome regulates and maintains human health: a primer and perspective for non-microbiologists. Cancer Res 2017;77:1783–812.
- Dzutsev A , Badger JH , Perez-Chanona E , Roy S , Salcedo R , Smith CK et al . Microbes and cancer. Annu Rev Immunol 2017;35:199–228.
- Helmink BA , Khan MAW , Hermann A , Gopalakrishnan V , Wargo JA . The microbiome, cancer, and cancer therapy. Nat Med 2019;25:377–88.
- Sears CL , Garrett WS . Microbes, microbiota, and colon cancer. Cell Host Microbe 2014;15:317–28.
- Pleguezuelos-Manzano C , Puschhof J , Rosendahl Huber A , van Hoeck A , Wood HM , Nomburg J et al . Mutational signature in colorectal cancer caused by genotoxic pks+ E. coli. Nature 2020;580:269–73.
- Okumura S , Konishi Y , Narukawa M , Sugiura Y , Yoshimoto S , Arai Y et al . Gut bacteria identified in colorectal cancer patients promote tumourigenesis via butyrate secretion. Nat Commun 2021;12:5674.
- Salvi PS , Cowles RA . Butyrate and the intestinal epithelium: modulation of proliferation and inflammation in homeostasis and disease. Cells 2021;10:1775.
- Fessler J , Matson V , Gajewski TF . Exploring the emerging role of the microbiome in cancer immunotherapy. J Immunother Cancer 2019;7:108.
- Gopalakrishnan V , Helmink BA , Spencer CN , Reuben A , Wargo JA . The influence of the gut microbiome on cancer, immunity, and cancer immunotherapy. Cancer Cell 2018;33:570–80.
- Zitvogel L , Ma Y , Raoult D , Kroemer G , Gajewski TF . The microbiome in cancer immunotherapy: diagnostic tools and therapeutic strategies. Science 2018;359:1366–70.
- Baruch EN , Youngster I , Ben-Betzalel G , Ortenberg R , Lahat A , Katz L et al . Fecal microbiota transplant promotes response in immunotherapy-refractory melanoma patients. Science 2021;371:602–9.
- Davar D , Dzutsev AK , McCulloch JA , Rodrigues RR , Chauvin J-M , Morrison RM et al . Fecal microbiota transplant overcomes resistance to anti–PD-1 therapy in melanoma patients. Science 2021;371:595–602.
- Griffin ME , Espinosa J , Becker JL , Luo J-D , Carroll TS , Jha JK et al . Enterococcus peptidoglycan remodeling promotes checkpoint inhibitor cancer immunotherapy. Science 2021;373:1040–6.
- Mager LF , Burkhard R , Pett N , Cooke NCA , Brown K , Ramay H et al . Microbiome-derived inosine modulates response to checkpoint inhibitor immunotherapy. Science 2020;369:1481–9.
- Ansaldo E , Belkaid Y . How microbiota improve immunotherapy. Science 2021;373:966–7.
- Ansaldo E , Farley TK , Belkaid Y . Control of immunity by the microbiota. Annu Rev Immunol 2021;39:449–79.
- Zhang Q , Ma C , Duan Y , Heinrich B , Rosato U , Diggs LP et al . Gut microbiome directs hepatocytes to recruit MDSCs and promote cholangiocarcinoma. Cancer Discov 2021;11:1248–67.
- Ding T , Schloss PD . Dynamics and associations of microbial community types across the human body. Nature 2014;509:357–60.
- Byrd AL , Liu M , Fujimura KE , Lyalina S , Nagarkar DR , Charbit B et al . Gut microbiome stability and dynamics in healthy donors and patients with non-gastrointestinal cancers. J Exp Med 2021;218:e20200606.
- Healy CM , Moran GP . The microbiome and oral cancer: more questions than answers. Oral Oncol 2019;89:30-3.
- Swaney MH , Kalan LR . Living in your skin: microbes, molecules and mechanisms. Infect Immun 2021;89:e00695–20.
- Willis JR , Gabaldón T . The human oral microbiome in health and disease: from sequences to ecosystems. Microorganisms 2020;8:308.
- Xu J , Peng J-J , Yang W , Fu K , Zhang Y . Vaginal microbiomes and ovarian cancer: a review. Am J Cancer Res 2020;10:743–56.
- Nejman D , Livyatan I , Fuks G , Gavert N , Zwang Y , Geller LT et al . The human tumor microbiome is composed of tumor type-specific intracellular bacteria. Science 2020;368:973–80.
- Jin C , Lagoudas GK , Zhao C , Bullman S , Bhutkar A , Hu B et al . Commensal microbiota promote lung cancer development via γδ T cells. Cell 2019;176:998–1013.
- Pushalkar S , Hundeyin M , Daley D , Zambirinis CP , Kurz E , Mishra A et al . The pancreatic cancer microbiome promotes oncogenesis by induction of innate and adaptive immune suppression. Cancer Discov 2018;8:403–16.
- McAllister F , Khan MAW , Helmink B , Wargo JA . The tumor microbiome in pancreatic cancer: bacteria and beyond. Cancer Cell 2019;36:577–9.
- Kadosh E , Snir-Alkalay I , Venkatachalam A , May S , Lasry A , Elyada E et al . The gut microbiome switches mutant p53 from tumour-suppressive to oncogenic. Nature 2020;586:133–8.
- Birch J , Gil J . Senescence and the SASP: many therapeutic avenues. Genes Dev 2020;34:1565–76.
- Faget DV , Ren Q , Stewart SA . Unmasking senescence: context-dependent effects of SASP in cancer. Nat Rev Cancer 2019;19:439–53.
- Gorgoulis V , Adams PD , Alimonti A , Bennett DC , Bischof O , Bishop C et al . Cellular senescence: defining a path forward. Cell 2019;179:813–27.
- He S , Sharpless NE . Senescence in health and disease. Cell 2017;169:1000–11.
- Kowald A , Passos JF , Kirkwood TBL . On the evolution of cellular senescence. Aging Cell 2020;19:e13270.
- Lee S , Schmitt CA . The dynamic nature of senescence in cancer. Nat Cell Biol 2019;21:94–101.
- Wang B , Kohli J , Demaria M . Senescent cells in cancer therapy: friends or foes? Trends Cancer 2020;6:838–57.
- Baker DJ , Childs BG , Durik M , Wijers ME , Sieben CJ , Zhong J et al . Naturally occurring p16(Ink4a)-positive cells shorten healthy lifespan. Nature 2016;530:184–9.
- Ruhland MK , Loza AJ , Capietto A-H , Luo X , Knolhoff BL , Flanagan KC et al . Stromal senescence establishes an immunosuppressive microenvironment that drives tumorigenesis. Nat Commun 2016;7:11762.
- Hwang HJ , Lee Y-R , Kang D , Lee HC , Seo HR , Ryu J-K et al . Endothelial cells under therapy-induced senescence secrete CXCL11, which increases aggressiveness of breast cancer cells. Cancer Lett 2020;490:100–10.
- Wang D , Xiao F , Feng Z , Li M , Kong L , Huang L et al . Sunitinib facilitates metastatic breast cancer spreading by inducing endothelial cell senescence. Breast Cancer Res 2020;22:103.
- Amor C , Feucht J , Leibold J , Ho Y-J , Zhu C , Alonso-Curbelo D et al . Senolytic CAR T cells reverse senescence-associated pathologies. Nature 2020;583:127–32.
- Aster JC , Pear WS , Blacklow SC . The varied roles of notch in cancer. Annu Rev Pathol 2017;12:245–75.
- Kuczynski EA , Vermeulen PB , Pezzella F , Kerbel RS , Reynolds AR . Vessel co-option in cancer. Nat Rev Clin Oncol 2019;16:469–93.
Google ScholarCrossref

 Suche
Suche
 Mein Konto
Mein Konto
