Bakterien in Pilzen liefern Hinweise auf die Ursprünge komplexen Lebens
Wissenschaftler implantieren Bakterien in Pilze, um die Ursprünge komplexen Lebens zu entschlüsseln und neue Symbiosen zu schaffen.
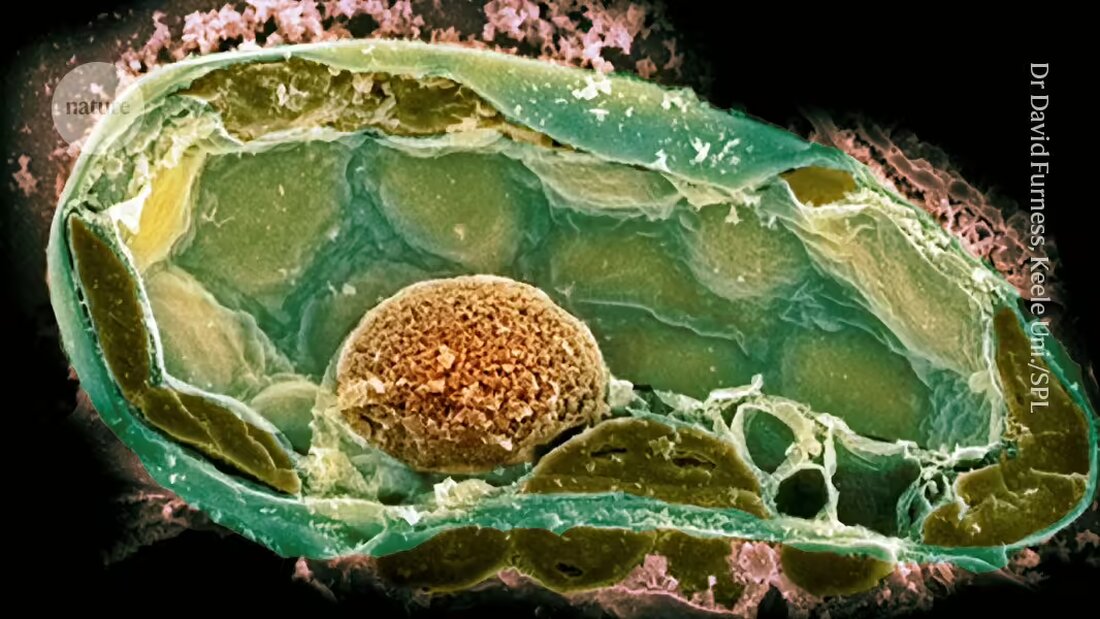
Bakterien in Pilzen liefern Hinweise auf die Ursprünge komplexen Lebens
Wissenschaftler, die eine winzige hohle Nadel und eine Fahrradpumpe verwenden, haben es geschafft, Bakterien in eine größere Zelle einzupflanzen. Dies schafft eine Beziehung, die denjenigen ähnelt, die die Evolution komplexen Lebens angestoßen haben.
Diese Leistung, die am 2. Oktober in der Zeitschrift Nature veröffentlicht wurde1, könnte Forschern helfen, die Ursprünge von Partnerschaften zu verstehen, die vor mehr als einer Milliarde Jahren zur Entstehung spezialisierter Organellen wie Mitochondrien und Chloroplasten führten.
Endosymbiontische Beziehungen, in denen ein mikrobakterieller Partner harmonisch in den Zellen eines anderen Organismus lebt, sind in zahlreichen Lebensformen zu finden, darunter Insekten und Pilze. Wissenschaftler glauben, dass Mitochondrien – die Organellen, die für die Energieproduktion in Zellen verantwortlich sind – entstanden, als ein Bakterium in einem Vorfahren der eukaryotischen Zellen Zuflucht fand. Chloroplasten entstanden, als ein Vorfahre der Pflanzen ein fotosynthetisches Mikroorganismus aufnahm.
Die Bestimmung der Faktoren, die diese Verbindungen gebildet und aufrechterhalten haben, ist schwierig, da sie so lange zurückliegen. Um dieses Problem zu umgehen, hat ein Team unter der Leitung von Mikrobiologin Julia Vorholt am Schweizerischen Bundesinstitut für Technologie in Zürich (ETH Zürich) in den letzten Jahren endosymbiotische Beziehungen im Labor entwickelt. Ihr Ansatz verwendet eine 500-1000 Nanometer breite Nadel, um Wirt-Zellen zu durchstechen und dann Bakterienzellen einzeln einzuführen.
Die ersten Versuche scheiterten jedoch häufig; ein Grund dafür war, dass der potenzielle Symbiont sich zu schnell teilte und seinen Wirt tötete2. Das Team hatte mehr Erfolg, als sie eine natürliche Symbiose zwischen einigen Stämmen des pilzlichen Pflanzenpathogens Rhizopus microsporus und dem Bakterium Mycetohabitans rhizoxinica rekreierten, das ein Toxin produziert, das den Pilz vor Prädation schützt.
Die Einführung von Bakterienzellen in die Pilze war jedoch eine Herausforderung, da sie dicke Zellwände haben, die einen hohen Innendruck aufrechterhalten. Nachdem die Wand mit der Nadel durchstochen wurde, verwendeten die Forscher eine Fahrradpumpe – später einen Kompressor –, um genug Druck aufrechtzuerhalten, um die Bakterien einzuführen.
Nach dem anfänglichen Schock der „Operation“ setzten die Pilze ihre Lebenszyklen fort und produzierten Sporen, von denen ein Teil Bakterien enthielt. Als diese Sporen keimten, waren auch Bakterien in den Zellen der nächsten Pilzgeneration vorhanden. Dies zeigte, dass die neue Endosymbiose auf den Nachwuchs übertragbar war – ein entscheidender Befund.
Allerdings war der Keimerfolg der Bakterien-haltigen Sporen niedrig. In einer gemischten Population von Sporen (einige mit Bakterien und einige ohne) verschwanden die Bakterienhaltigen nach zwei Generationen. Um die Beziehungen zu verbessern, verwendeten die Forscher einen fluoreszierenden Zellsortierer, um Sporen auszuwählen, die Bakterien enthielten – die mit einem leuchtenden Protein markiert worden waren – und propagierten nur diese Sporen in zukünftigen Fortpflanzungsrunden. Nach zehn Generationen keimten die Bakterien-haltigen Sporen nahezu genauso effizient wie die ohne Bakterien.
Die Grundlage für diese Anpassung ist nicht klar. Genomsequenzierung identifizierte einige Mutationen, die mit dem verbesserten Keimerfolg im Pilz – einem Stamm von R. microsporus, der nicht bekannt ist, Endosymbionten zu tragen – assoziiert waren und fand keine Veränderungen in den Bakterien.
Die Linie, die am effizientesten keimte, schien die Anzahl der Bakterien in jeder Spore zu begrenzen, sagt Gabriel Giger, Mitautor der Studie und Mikrobiologe an der ETH Zürich. „Es gibt Möglichkeiten, wie diese beiden Partner besser und einfacher zusammenleben können. Das ist etwas, das für uns sehr wichtig ist zu verstehen.“
Über das Immunsystem der Pilze wissen die Forscher noch nicht viel. Aber Thomas Richards, Evolutionsbiologe an der Universität Oxford, UK, fragt sich, ob ein pilzlichen Immunsystem die Symbiose verhindert – und ob Mutationen in diesem System die Beziehungen erleichtern könnten. “Ich bin ein großer Fan dieser Arbeit,” fügt er hinzu.
Eva Nowack, Mikrobiologin an der Heinrich-Heine-Universität Düsseldorf, Deutschland, war überrascht, wie schnell Anpassungen an das symbiotische Leben zu entstehen schienen. In Zukunft würde sie gerne sehen, was nach noch längeren Zeiträumen geschieht; zum Beispiel nach mehr als 1.000 Generationen.
Die Entwicklung solcher Symbiosen könnte zur Schaffung neuer Organismen mit nützlichen Eigenschaften führen, wie die Fähigkeit, Kohlenstoffdioxid oder atmosphärisches Nitrogen zu konsumieren, sagt Vorholt. „Das ist die Idee: neue Eigenschaften zu schaffen, die ein Organismus nicht hat und die ansonsten schwierig umzusetzen wären.“
-
Giger, G. H. et al. Nature https://doi.org/10.1038/s41586-024-08010-x (2024).
-
Gäbelein, C. G., Reiter, M. A., Ernst, C., Giger, G. H. & Vorholt, J. A. ACS Synth. Biol. 11, 3388–3396 (2022).

 Suche
Suche
 Mein Konto
Mein Konto
